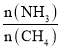题目内容
【题目】某化学学习小组设计以下实验方案:测定某含有NaCl的小苏打样品中![]() 的质量分数。已知:
的质量分数。已知:![]() 受热分解成碳酸钠、二氧化碳和水。
受热分解成碳酸钠、二氧化碳和水。
(方案一)称取一定质量样品,置于仪器A中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)仪器A的名称为___________;A应该放在_________中冷却。恒重操作的目的是________。
(2)本实验从称量空的A仪器开始,完成一次平行实验至少需要称重____次。做平行实验的目的是___________。
(方案二)称取一定质量的样品(样品的质量为m0),置于小烧杯中,加适量水溶解;向小烧杯中加入足量澄清石灰水,过滤,洗涤、干燥,称量沉淀的质量为m1,计算。(已知碳酸钙式量为100,![]() 的式量为84)。
的式量为84)。
(3)反应方程式为_____________,则样品中![]() 的质量分数可以表示为_________。
的质量分数可以表示为_________。
(方案三)往Y形管中注入一定体积和浓度的稀硫酸并放入准确称取的ag样品,连接好注射器(如图),再将Y形管倾斜,使样品与酸液充分反应。
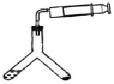
(4)a不能太大,理由是___________,若测定结果偏高,其原因可能是______(选填序号)。
①样品未完全反应
②温度未恒定即记录数据
③少量![]() 溶解在溶液中
溶解在溶液中
(方案四)称取一定质量样品,配成待测溶液,用标准盐酸滴定。
(5)下列叙述正确的是_______(选填序号)。
①用烧杯配制100mL待测溶液
②用酚酞为指示剂
③当滴至待测液变色并能将该颜色保持半分钟即为滴定终点
④盛盐酸的滴定管未润洗会造成实验结果偏高
【答案】坩埚 干燥器 确保NaHCO3分解完全 4 减小实验误差 NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O ![]() 受酸的量和注射器容积的限制 ② ③④
受酸的量和注射器容积的限制 ② ③④
【解析】
(1)该方案原理为在加热的条件下Na2CO3能够稳定存在,而NaHCO3较易发生如下的分解反应2NaHCO3![]() Na2CO3+CO2↑+H2O,从而可根据其反应产生的CO2和水蒸气H2O的量或残留的固体的量推算出小苏打样品中NaHCO3的质量分数;一般用坩埚加热灼烧固体,加热后放在干燥器中冷却,防止物质吸收空气中的水蒸气,该方案根据加热后残渣的质量来求解,自然要加热至恒重;
Na2CO3+CO2↑+H2O,从而可根据其反应产生的CO2和水蒸气H2O的量或残留的固体的量推算出小苏打样品中NaHCO3的质量分数;一般用坩埚加热灼烧固体,加热后放在干燥器中冷却,防止物质吸收空气中的水蒸气,该方案根据加热后残渣的质量来求解,自然要加热至恒重;
(2)该实验要称量空坩埚的质量,称量坩埚和样品的总质量,加热至恒重后,冷却,称量两次坩埚和剩余固体的质量;做平行实验的目的是减小实验误差;
(3)样品中NaHCO3与Ca(OH)2发生反应;根据化学方程式中NaHCO3和CaCO3的物质的量关系进行求解;
(4)样品要保证完全与酸液发生反应,还要用注射器测定生成气体体积,所以质量不能太大;分析操作对实验结果的影响进行判断;
(5)应用酸碱滴定的原理和操作步骤进行分析判断。
(1)该方案原理为在加热的条件下Na2CO3能够稳定存在,而NaHCO3较易发生如下的分解反应2NaHCO3![]() Na2CO3+CO2↑+H2O,从而可根据其反应产生的CO2和水蒸气H2O的量或残留的固体的量推算出小苏打样品中NaHCO3的质量分数;一般用坩埚加热灼烧固体,加热后放在干燥器中冷却,防止物质吸收空气中的水蒸气,该方案根据加热后残渣的质量来求解,自然要加热至恒重,以确保NaHCO3分解完全;故答案为:坩埚;干燥器;确保NaHCO3分解完全;
Na2CO3+CO2↑+H2O,从而可根据其反应产生的CO2和水蒸气H2O的量或残留的固体的量推算出小苏打样品中NaHCO3的质量分数;一般用坩埚加热灼烧固体,加热后放在干燥器中冷却,防止物质吸收空气中的水蒸气,该方案根据加热后残渣的质量来求解,自然要加热至恒重,以确保NaHCO3分解完全;故答案为:坩埚;干燥器;确保NaHCO3分解完全;
(2)该实验要称量空坩埚的质量,称量坩埚和样品的总质量,加热至恒重后,冷却,称量两次坩埚和剩余固体的质量;做平行实验的目的是减小实验误差;故答案为:4;减小实验误差;
(3)样品中NaHCO3与Ca(OH)2发生反应,化学方程式为NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O;n(CaCO3)=![]() mol,n(NaHCO3)= n(CaCO3)=
mol,n(NaHCO3)= n(CaCO3)=![]() mol,m(NaHCO3)=
mol,m(NaHCO3)=![]() mol
mol![]() 84g/mol=
84g/mol=![]() g,则样品中NaHCO3的质量分数为
g,则样品中NaHCO3的质量分数为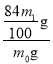 =
=![]() ;故答案为:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O;
;故答案为:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O;![]() ;
;
(4)样品要保证完全与酸液发生反应,还要用注射器测定生成气体体积,所以质量不能太大;若样品未完全反应,则生成气体体积偏小,导致计算结果偏小;该反应放热,若温度未恒定即记录数据,导致气体体积数据偏大,计算结果偏大;若少量CO2溶解在溶液中,会导致气体体积偏小,计算结果偏小;故答案为:受酸的量和注射器容积的限制;②;
(5)①配制溶液应该使用容量瓶而不是烧杯,故①错误;
②盐酸滴定碳酸氢钠溶液,滴定终点溶液显酸性,而酚酞变色范围是pH8.0-10.0,与滴定终点溶液pH不符,故②错误;
③当滴至待测液变色并能将该颜色保持半分钟即为滴定终点,故③正确;
④盛盐酸的滴定管未润洗相当于稀释盐酸,会导致盐酸消耗体积偏大,造成实验结果偏高,故④正确;
故答案为:③④。

【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
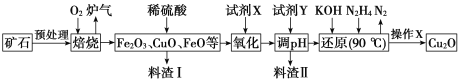
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是___________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________。
(2)试剂X是H2O2溶液,当试剂X是___________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是________。
(4)“还原”步骤中为提高N2H4转化率可采取的措施有_________(填序号)。
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为_______________
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是____________。
(7)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式为________
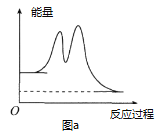
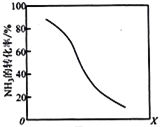
(8)工业上用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)HCN(g)+3H2(g ) △H>0。其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。则X可以是___________(填字母序号)
a.温度 b.压强 c.催化剂 d.