题目内容
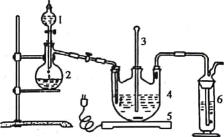
【题目】某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图
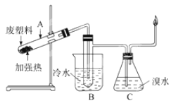
加热聚丙烯废塑料得到的产物如表:
产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔:
![]()
写出反应(2)的化学方程式__________________________________。
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有____种。
(3)经锥形瓶C中溴水充分吸收,剩余气体经过干燥后的平均相对分子质量为_______。
【答案】CaC2+2H2O→CH≡CH↑+Ca(OH)2 4 4.8
【解析】
(1)碳化钙和水反应制取乙炔,同时生成氢氧化钙;
(2)试管B中含有苯和甲苯,苯不能使高锰酸钾褪色,甲苯可以使高锰酸钾褪色;
(3)进入C中气体有:氢气、甲烷、乙烯、丙烯,烯烃与溴单质发生加成反应,剩余气体为甲烷和氢气,质量比为2:1,计算出物质的量之比,再计算出平均摩尔质量即可。
(1)反应②是碳化钙和水反应生成乙炔与氢氧化钙,反应方程式为:CaC2+2H2O→CH≡CH↑+Ca(OH)2,故答案为:CaC2+2H2O→CH≡CH↑+Ca(OH)2;
(2)试管B中含有苯和甲苯,苯不能使高锰酸钾褪色,甲苯可以使高锰酸钾褪色,一氯甲苯的同分异构体有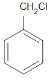 、
、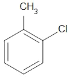 、
、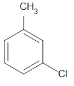 、
、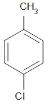 ,共有4种,故答案为:4;
,共有4种,故答案为:4;
(3)进入C中气体有:氢气、甲烷、乙烯、丙烯,烯烃与溴单质发生加成反应,使溴水褪色,经溴水充分吸收后剩余气体为甲烷和氢气,二者质量比为24%:12%=2:1,物质的量比为![]() :
:![]() =1:4,平均相对分子质量为:
=1:4,平均相对分子质量为:![]() =4.8,故答案为:4.8。
=4.8,故答案为:4.8。

【题目】Na2O2具有漂白性和较强的氧化性,下面是某实验小组设计的过氧化钠性质探究实验。回答下列问题:
探究Na2O2与H2反应:
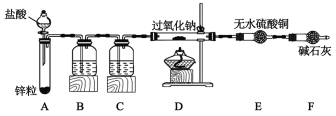
(1)装置B中所盛试剂的名称是___,其作用是___,为了简化实验,可用代替B和C装置___(填写装置名称和装置中所盛试剂的名称)。
(2)装入药品后,点燃D处酒精灯之前的操作是___。
(3)根据下表中的信息,完成对反应情况的探究。
步骤 | 现象 | 结论 |
点燃D处酒精灯 | D中Na2O2逐渐熔化,颜色由①___(填颜色变化),E处无明显现象。 | 加热条件下Na2O2与H2发生反应。 |
反应结束后,待D装置冷却后,取少量D中物质于试管中,加入适量水和几滴酚酞。 | ②___ | Na2O2反应后无剩余,Na2O2与H2反应的化学方程式为:③___。 |
探究Na2O2与水的反应:
(4)用脱脂棉包裹Na2O2粉末,然后滴几滴蒸馏水,发现脱脂棉燃烧起来,试分析其中的原因:___。
(5)有资料显示,Na2O2与水反应后的溶液中有H2O2,设计一个简单的实验证明H2O2的存在:___。