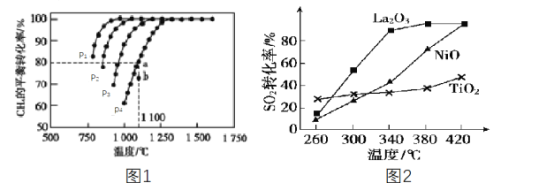
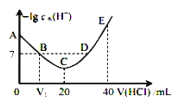
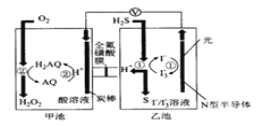
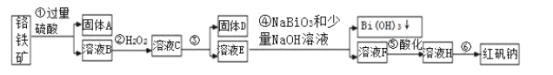
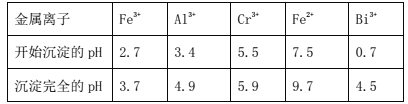
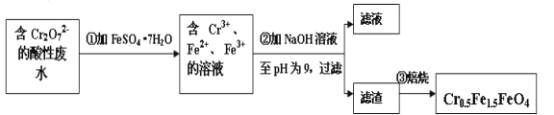
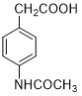
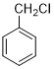
0 203097 203105 203111 203115 203121 203123 203127 203133 203135 203141 203147 203151 203153 203157 203163 203165 203171 203175 203177 203181 203183 203187 203189 203191 203192 203193 203195 203196 203197 203199 203201 203205 203207 203211 203213 203217 203223 203225 203231 203235 203237 203241 203247 203253 203255 203261 203265 203267 203273 203277 203283 203291 203614