题目内容
【题目】Ⅰ.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),工艺流程如图:
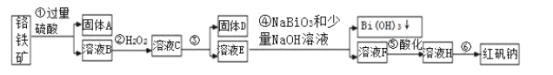
i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为CrO42-。
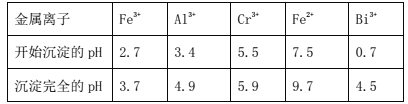
ii.常温时,部分金属离子开始沉淀和完全沉淀时的pH值
(1)步骤①提高酸溶速率的措施__(任填一条即可)。固体A的成分是___。
(2)步骤③需加氢氧化钠溶液调节pH,调节pH范围为__,目的是__。
(3)写出④反应的离子方程式__。
(4)将溶液H经过__即得红矾钠粗晶体。
Ⅱ.经该工厂的工业废水中含1.00×10-3mol·L-1的Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),又设计了如下工艺流程:
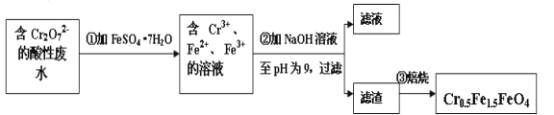
(5)第①步反应的离子方程式是__。
(6)常温时,如忽略步骤①所加FeSO4·7H2O所引起的溶液体积变化,依据上表数据,则步骤②加入NaOH溶液调节溶液的pH至9时,溶液中Cr3+的浓度为___mol/L(101/2≈3.2)。
(7)欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O的质量为__g(已知FeSO4·7H2O的摩尔质量为278g/mol)。
【答案】加热/搅拌/粉碎/适当提高稀硫酸的浓度(任写一条) SiO2 4.9≤pH<5.5 使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去 3NaBiO3 + 2Cr3+ +7OH- + H2O = 2Cr2O72 + 3Bi(OH)3↓+3Na+ 蒸发浓缩、冷却结晶、过滤洗涤干燥 Cr2O72 + 6Fe2++14H+ = 2Cr3+ + 6Fe3++7H2O 6.4×1014 2.78
【解析】
铬铁矿中的FeO、Cr2O3和Al2O3均能溶于硫酸,SiO2不溶,过滤,向滤液中加入双氧水,氧化亚铁离子,步骤③的目的是使Fe3+、Al3+沉淀,过滤,向滤液中加入NaBiO3、NaOH,能将Cr3+转化为Cr2O72,过滤,将滤液蒸发浓缩、冷却结晶、过滤洗涤干燥得到Na2Cr2O7·2H2O。
⑴加热、搅拌、粉碎、适当提高稀硫酸的浓度均可加快化学反应速率,任答一种即可。按照元素化合物知识,铬铁矿中的FeO、Cr2O3和Al2O3均能溶于硫酸,SiO2不溶,故第①步得到的固体A为SiO2;故答案为:加热/搅拌/粉碎/适当提高稀硫酸的浓度(任写一条);SiO2。
⑵步骤③的目的是使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去,但不能使Cr3+沉淀,故需要调节的pH范围为4.9≤pH<5.5,故答案为:4.9≤pH<5.5;使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去。
⑶常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为Cr2O72,则反应的离子方程式为3NaBiO3 + 2Cr3+ +7OH- + H2O = 2Cr2O72 + 3Bi(OH)3↓+3Na+;故答案为:3NaBiO3 + 2Cr3+ +7OH- + H2O = 2Cr2O72 + 3Bi(OH)3↓+3Na+。
⑷溶液H得红矾钠粗晶体需经过蒸发浓缩、冷却结晶、过滤洗涤干燥;故答案为:蒸发浓缩、冷却结晶、过滤洗涤干燥。
⑸Cr2O72有强氧化性,FeSO4·7H2O中Fe2+有一定的还原性,在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,根据元素守恒及所处环境可知,还有水生成,反应离子方程式为Cr2O72 + 6Fe2++14H+ = 2Cr3+ + 6Fe3++7H2O;故答案为:Cr2O72 + 6Fe2++14H+ = 2Cr3+ + 6Fe3++7H2O。
⑹常温时,如忽略步骤①所加FeSO4·7H2O所引起的溶液体积变化,依据上表数据得到Cr3+开始沉淀时pH =5.5,即![]() ,则
,则![]() ,步骤②加入NaOH溶液调节溶液的pH至9时,
,步骤②加入NaOH溶液调节溶液的pH至9时,![]() ,则溶液中Cr3+的浓度为
,则溶液中Cr3+的浓度为![]() ,
,![]() ;故答案为;6.4×1014 mol·L1。
;故答案为;6.4×1014 mol·L1。
⑺欲使1L该废水中n(Cr2O72)=1×103 mol,根据Cr原子、Fe原子守恒,可得Cr2O72~4Cr0.5Fe1.5FeO4~10FeSO4·7H2O,因此理论上n(FeSO4·7H2O)=10n(Cr2O72)=10×1×103 mol =0.01mol,所以质量m(FeSO4·7H2O) = 0.01mol×278 gmol1=2.78g;故答案为

【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
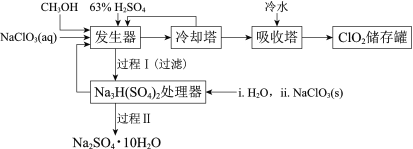
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH= 12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O
b.相关物质的熔沸点:
物质 | CH3OH | HCOOH | ClO2 |
熔点/℃ | -97 | 9 | -59 |
沸点/℃ | 65 | 101 | 11 |
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有______性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为______(填字母)。
A.0~10℃ B.20~30℃ C.60~70℃
(3)经过程Ⅰ和过程Ⅱ可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。
已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如下图:
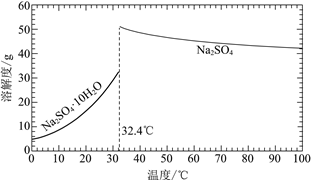
①Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因:______。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和______。
【题目】表为元素周期表的一部分,表中a~f代表六种短周期主族元素。完成下列填空:
a | b | c |
d | e | f |
(1)六种元素中,原子半径最大的是_________ (填元素编号) 。d、e、f三种元素的原子结构上的相同点是________________________________。
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是___________;六种元素中,最高价氧化物对应水化物的酸性最强的是_________(填元素符号)。
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性_________(选填“强”、“弱’’),能说明这一事实的化学方程式是____________________(任写一个)。
(4)若b为非金属元素,则以下推断正确的是_________(选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素