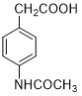
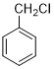
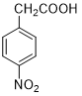
题目内容
【题目】我国科学家在天然气脱硫研究方面取得了新进展,其原理如图所示。下列有关说法错误的是( )
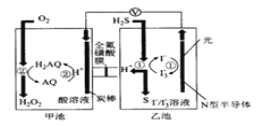
A.图中导线上标记方向为电子流向
B.装置中H+向甲池迁移
C.正极上的电极反应式为O2+4H++4e-=2H2O
D.乙池溶液中发生反应的离子方程式:H2S+I3- =3I-+S↓+2H+
【答案】C
【解析】
A. 分析N型半导体是I-失去电子变为I3-,为负极,甲池是AQ得到电子,为正极,因此图中导线上标记方向为电子流向,故A正确;
B. 根据原电池 “同性相吸”原理和A选项分析得到装置中H+向正极即甲池迁移,故B正确;
C. 正极上的电极反应式为AQ + 2H++2e- = H2AQ,故C错误;
D. 乙池溶液中H2S与I3-反应生成S和I-,其反应的离子方程式:H2S+I3- = 3I-+S↓+2H+,故D正确。
综上所述,答案为C。

【题目】测定硫酸铜晶体(CuSO4XH2O )中X值的实验过程如下:
![]()
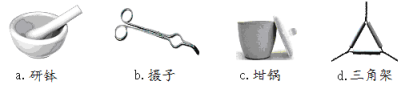
(1)下列是实验中用到的几种仪器,仪器与对应名称正确的是___________。
(2)“灼烧”时热源选用的是酒精灯而不是酒精喷灯,理由是_____________________;“冷却”放在_______________中(填仪器名称)。
(3) “恒重”操作的目的是_________________________________________________;
判断“恒重”的依据是_________________________________________________。
(4)下面是某学生实验的一次数据,请完成计算
坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
11.721g | 22.692g | 18.631g |
X=__________________;(精确到0.01),实验相对误差是_________________。(保留小数点后一位)
(5)这次实验中产生误差的原因可能是__________所造成的。
a.硫酸铜晶体中含有不挥发性杂质 b.在加热过程发现有黑色物质生成
c.加热时有晶体飞溅出来 d.加热失水后露置在空气中冷却
【题目】氧化铜与硫酸反应得硫酸铜。
(1)胆矾晶体结晶水含量测定实验中,恒重操作完成的标准是______________。
(2)利用如图装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃。反应前后各装置的质量如图下方的表格所示。

装置 | A(试管+粉末) | B | C |
反应前 | 50.0 g | 70.0 g | 540.0 g |
反应后 | 45.0 g | 74.5 g | 540.0 g |
请通过计算,推断该实验条件下硫酸铜分解的化学方程式:_______________。