题目内容
【题目】环境治理依然是当今的热点问题。研究相关问题具有重要意义。回答下列问题:
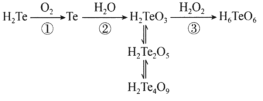
(1)2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g) 快 ΔH1<0
N2O2(g) 快 ΔH1<0
②N2O2(g)+O2(g)![]() 2NO2(g) 慢 ΔH2<0
2NO2(g) 慢 ΔH2<0
反应2NO(g)+O2(g)![]() 2NO2(g)的H=__(用含H1和H2的式子表示)。反应①的活化能E1与反应②的活化能E2的大小关系为E1__E2(填“>”、“<”或“=”)。
2NO2(g)的H=__(用含H1和H2的式子表示)。反应①的活化能E1与反应②的活化能E2的大小关系为E1__E2(填“>”、“<”或“=”)。
(2)工业上常利用CH4来吸收CO2生成CO和H2,再用H2和CO合成甲醇。如在恒容密闭容器中通入物质的量浓度均为1.0mol·L-1的CH4与CO2,在一定条件下仅发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1所示:
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1所示:
则:①该反应的ΔH___(填“<”“=”或“>”)0。
②压强p1、p2、p3、p4由大到小的关系为___。判断的理由是______。压强为p4时,在b点:v(正)___(填“<”“=”或“>”)v(逆)。
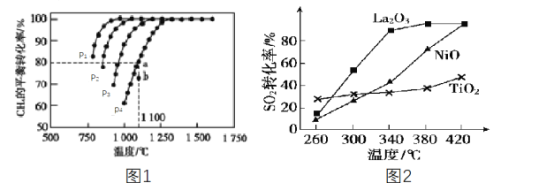
③对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),当p4=0.36MPa,则a点的平衡常数Kp=___(保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气中硫的回收反应为2CO(g)+SO2(g)=2CO2(g)+S(l)。在其他条件相同、催化剂不同时,硫的回收反应中SO2的转化率随反应温度的变化如图2所示。260℃时,____ (填“La2O3”NiO”或“TiO2”)的催化效率最高。La2O3和NiO作催化剂均可能使SO2的转化率达到很高,不考虑价格因素,选择La2O3的主要优点是__。
(4)该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图3,写出开始电解时阳极的电极反应式__。

【答案】ΔH1 + ΔH2 < > P4>P3>P2>P1 该反应的正反应为气体分子数增大的反应,温度不变时,降低压强,平衡向正反应方向移动,甲烷的平衡转化率增大 > 1.64 TiO2 La2O3在相对较低温度对催化效率更高或其他合理表述 HSO3- + 2e- + H2O= SO42 + 3H+
【解析】
⑴利用盖斯定律,将第一个反应与第二个反应相加即得目标反应;反应①快,反应②慢,说明反应②需要克服的化学能较高。
⑵①根据图示,压强不变时,升高温度,甲烷的平衡转化率增大,说明平衡时向正反应方向移动,根据升温时平衡向吸热反应方向移动;②该反应的正反应为气体分子数增大的反应,温度不变时,降低压强,平衡向正反应方向移动,甲烷的平衡转化率增大;压强为P4时,b点为达到平衡时,反应正向进行;③由用平衡浓度表示的平衡常数类推可知,先求出P4时a点甲烷的平衡转化率为80%,再求各物质物质的量浓度,再求出压强平衡常数。
⑶由图2可知,260℃时,TiO2做催化剂时,SO2的转化率最高,在340℃时,La2O3催化下SO2的转化率接近90%然后维持在较高水平,同期NiO和TiO2催化下的SO2的转化率较低。
⑷由图可知,阳极实现了HSO3-向SO42的转化过程。
⑴利用盖斯定律,将第一个反应与第二个反应相加即得目标反应,因此H=ΔH1 + ΔH2,反应①快,反应②慢,说明反应速率决定于反应②,也说明反应②需要克服的化学能较高,故E1<E2;故答案为:ΔH1 + ΔH2;<。
⑵①根据图示,压强不变时,升高温度,甲烷的平衡转化率增大,说明平衡时向正反应方向移动,根据升温时平衡向吸热反应方向移动可知,正反应为吸热反应,ΔH>0;故答案为:>。
②该反应的正反应为气体分子数增大的反应,温度不变时,降低压强,平衡向正反应方向移动,甲烷的平衡转化率增大,故P4>P3>P2>P1,压强为P4时,b点为达到平衡时,反应正向进行,故υ(正) >υ(逆);故答案为:P4>P3>P2>P1;该反应的正反应为气体分子数增大的反应,温度不变时,降低压强,平衡向正反应方向移动,甲烷的平衡转化率增大;>。
③由用平衡浓度表示的平衡常数类推可知,用平衡压强表示的压强常数![]() ,P4时a点甲烷的平衡转化率为80%,则平衡时c(CH4) = c(CO2) =0.2 mol·L1,c(CO) = c(H2) =1.6 mol·L1,
,P4时a点甲烷的平衡转化率为80%,则平衡时c(CH4) = c(CO2) =0.2 mol·L1,c(CO) = c(H2) =1.6 mol·L1, ;故答案为:1.64。
;故答案为:1.64。
⑶由图2可知,260℃时,TiO2做催化剂时,SO2的转化率最高,故TiO2的催化效率最高,随着温度升高,SO2的转化率逐渐升高,但增加程度不一样,在340℃时,La2O3催化下SO2的转化率接近90%然后维持在较高水平,同期NiO和TiO2催化下的SO2的转化率较低,到420℃时,NiO催化下SO2的转化率与La2O3相同,此时TiO2的依然较低,综上理想的反应条件为340℃,选用La2O3做催化剂;故答案为:TiO2;La2O3在相对较低温度对催化效率更高或其他合理表述。
⑷由图可知,阳极实现了HSO3-向SO42的转化过程,其电极反应式为HSO3- + 2e- + H2O= SO42 + 3H+;故答案为:HSO3- + 2e- + H2O= SO42 + 3H+。

【题目】中和滴定不仅可以测定酸或碱的物质的量浓度,还可以测定某些混合物的含量。
烧碱是重要的化工原料,工业烧碱中可能含有少量NaCl。为测定工业烧碱样品中NaOH的质量分数,进行如下实验:
①称取1. 000g样品,配制成250mL待测液。
②量取20.00mL待测液,用0.1000mol/L标准盐酸溶液滴定。
(1)将1.000g样品配成250mL待测液,所用的玻璃仪器有:烧杯、玻璃棒、胶头滴管 _____________________________________;
(2)量取20.00mL待测液所用的仪器是_______________________;选用的指示剂为_____________________。
(3)滴定操作过程中,眼睛应注视____________________________________________;判断达到滴定终点的依据为_______________________________________________。
(4)第一组学生在测定时,标准盐酸滴过了头,该组学生又加了2.80mL待测液,继续做实验,这种操作__________(填:合理或不合理)。
(5)第二组学生在滴定过程中,不小心将标准液滴在锥形瓶的内壁上,一学生提议用蒸馏水将液滴冲下去,你认为这样操作使结果_______ (填:偏高、偏低或没有影响)。
(6)第三组学生进行了两次滴定,消耗标准盐酸体积的数据如表,其中第2次滴定后滴定管的读数如图所示,将这一读数填入表中。
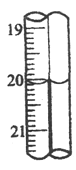
次数 | 滴定前(mL) | 滴定后 |
1 | 0.40 | 20.10 |
2 | 0.10 | ____________ |
该组学生所测得的烧碱样品中NaOH的质量分数为__________________。