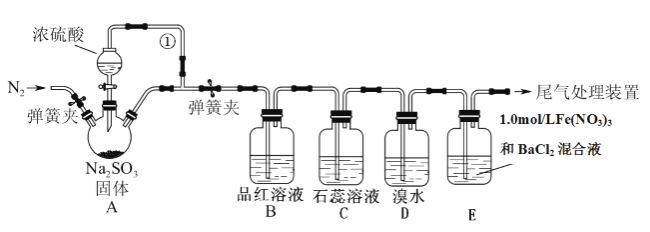
【题目】苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过如图所示的流程由甲苯氧化制备苯甲醛。
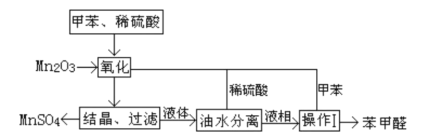
试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是___。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离,该过程中需将混合物冷却,其目的___。
(3)实验过程中,可循环使用的物质分别为___,___。
(4)实验中分离甲苯和苯甲醛采用的操作I是___________。
(5)实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表),
反应时间/h | 1 | 2 | 3 | 4 | 5 |
苯甲醛产率/% | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因___。