题目内容
【题目】阅读下列材料,完成相应填空
某同学设计了如下装置用于制取SO2和验证SO2的性质。已知:1.0mol/L的Fe(NO3)3溶液的![]() 。试回答以下问题:
。试回答以下问题:
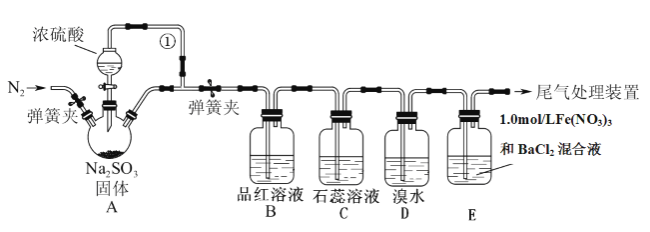
(1)装置A中用于添加浓硫酸的仪器名称为________________________,导管①的作用是______________________。
(2)B、C、D三个装置分别先后验证了SO2的哪些性质_______。
A.吸附性、酸性、还原性 B.还原性、酸性、还原性
C.漂白性、酸性、还原性 D.漂白性、酸性、氧化性
(3)SO2和品红反应的原理是_______________________________。
(4)实验前鼓入N2的目的是____________________________,简述此操作是否有必要_______________________________
(5)装置E中产生了白色沉淀,其成分是______________(填名称),分析E中产生白色沉淀的可能原因及观察到的现象。(写两种)可能①:_____________________;现象:___________。可能②:_____________________;现象:___________。
(6)若用2.0mol/L 的NaOH溶液吸收SO2尾气,请画出该尾气吸收装置_______。
【答案】分液漏斗 平衡压强,使分液漏斗内液体能够顺利流下 C 与品红作用生成不稳定的无色物质 排净装置中的空气 有必要,防止溶液中SO2被空气中的O2氧化而干扰E中实验 BaSO4 SO2与Fe3+反应生成SO42- 溶液由棕黄色变为浅绿色 在酸性条件下SO2与NO3-反应生成SO42- 溶液中有气泡产生 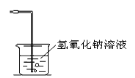
【解析】
反应产生气体,气压变大,若没有导管①平衡压强,分液漏斗内液体不能够顺利流下;因二氧化硫具有漂白性,则B中的品红溶液褪色,二氧化硫与水反应生成亚硫酸,遇石蕊变红,说明二氧化硫为酸性气体;D中二氧化硫与碘水发生氧化还原反应生成硫酸和HBr酸,该反应为SO2+Br2+2H2O═2HBr+H2SO4,二氧化硫中S元素的化合价升高,说明二氧化硫具有还原性;SO2和品红反应的原理是与品红作用生成不稳定的无色物质;氧气能将二氧化硫氧化,所以鼓入氮气的目的是排净空气防止干扰实验;二氧化硫具有还原性,酸性条件下,能被硝酸根离子或铁离子氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀;①若二氧化硫和铁离子发生氧化还原反应生成硫酸根离子和亚铁离子,硫酸根离子和钡离子反应生成白色沉淀,溶液由黄色变为浅绿色,所以除产生沉淀外,还应观察到的现象是静置一段时间后,溶液由棕黄色变为浅绿色;②若酸性条件下,硝酸根离子和二氧化硫发生氧化还原反应生成硫酸根离子和NO气体,硫酸根离子和钡离子反应生成硫酸钡白色沉淀。
(1)该仪器名称为分液漏斗;反应产生气体,气压变大,若没有导管①平衡压强,分液漏斗内液体不能够顺利流下;
(2)B中的品红溶液褪色,因二氧化硫具有漂白性;二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象为变红,说明二氧化硫为酸性气体;D中二氧化硫与碘水发生氧化还原反应生成硫酸和HBr酸,该反应为SO2+Br2+2H2O═2HBr+H2SO4,二氧化硫中S元素的化合价升高,说明二氧化硫具有还原性;
(3)SO2和品红反应的原理是与品红作用生成不稳定的无色物质;
(4)氧气、硝酸根离子都能将二氧化硫氧化,所以如果装置中含有氧气,会干扰实验,所以排入氮气的目的是排净空气防止干扰实验;
(5)二氧化硫具有还原性,酸性条件下,能被硝酸根离子或铁离子氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀;①若二氧化硫和铁离子发生氧化还原反应生成硫酸根离子和亚铁离子,硫酸根离子和钡离子反应生成白色沉淀,溶液由黄色变为浅绿色,所以除产生沉淀外,还应观察到的现象是静置一段时间后,溶液由棕黄色变为浅绿色;②若酸性条件下,硝酸根离子和二氧化硫发生氧化还原反应生成硫酸根离子和NO气体,硫酸根离子和钡离子反应生成硫酸钡白色沉淀;
故答案为:SO2与Fe3+反应生成SO42-;静置一段时间后,溶液由棕黄色变为浅绿色;在酸性条件下SO2与硝酸根反应生成SO42-;溶液中有气泡产生;
(6)使用氢氧化钠溶液吸收多余的二氧化硫,故答案为: 。
。

 阅读快车系列答案
阅读快车系列答案