��Ŀ����
����Ŀ��Һ�ȴ����г�����NCl3����Һ����NCl3�����������ﵽ4%���Ͼ��б�ըΣ�ա�
(1)NCl3��ˮ������һ�ּ��������һ�־���Ư���Ե����ʡ�д���÷�Ӧ�Ļ�ѧ����ʽ________________________________________________��
(2)Ϊ�ⶨ�����е�NCl3��������һ������Ʒ��ͨ��������������NCl3(��ӦΪ��NCl3+4HCl��NH4Cl+3Cl2)������400 mL 20.0%(��=1.22g/cm3)�Ĺ�ҵNaOH��Һ�������е�Cl2��������պ�NaOH��Һ����51.4 g�����ⶨNCl3���չ���NH4+����Ϊ0.270 g��
��������ҵNaOH��Һ�����ʵ���Ũ��Ϊ____________��
�ڼ������Ʒ��NCl3���������������жϸ���Ʒ�Ƿ�ȫ��(д���������)____________��
���𰸡�NCl3+3H2O��NH3+3HClO 6.1mol/L n(NH4+)=0.015mol��m (NCl3)=1.8075g��ԭ����������Ϊ51.4-3.195=48.205 g��
NCl3%=3.61%������Ʒ��ȫ
��������
������֪��Ϣ�ƲⷴӦ���������֪�������Ƶ������������ܶȿɸ��ݹ�ʽ���ܶȣ���������������㷽����Һ����NCl3�����������ﵽ4%���Ͼ��б�ըΣ�ս��
(1)������Ϣ���Ʋ⣬NCl3����ˮ��Ӧ����һ�ּ������就����һ�־���Ư���Ե����ʴ����ᣬ�ʷ�Ӧ����ʽΪ��NCl3+3H2O��NH3+3HClO��
(2) ��20.0%����=1.22g/cm3���Ĺ�ҵNaOH��Һ����Ũ��Ϊ![]() ��
��
�ڲⶨNCl3���չ���NH4+����Ϊ0.270g��n��NH4+��=0.015mol���ɷ�Ӧ��֪��n��NCl3��=0.015mol����m��NCl3��=0.015mol��120.5g/mol=1.8075g�������ᴦ����������Ϊ0.015mol��3��71g/mol=3.195g��ԭ����������Ϊ51.4-3.195=48.205 g����![]() �������Ʒ��ȫ��
�������Ʒ��ȫ��

 һ����ʦȨ����ҵ��ϵ�д�
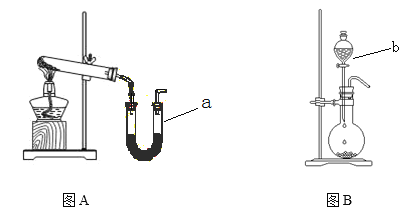
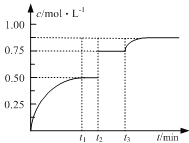
һ����ʦȨ����ҵ��ϵ�д�����Ŀ�������ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㡣��ѧ�������о����ô�������β���е�NO��COת���CO2��N2����ѧ����ʽ���£�2NO��2CO![]() 2CO2��N2��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������
2CO2��N2��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10��4mol��L��1) | 10 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
c(CO)/(10��3mol��L��1) | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
��ش���������(���������¶ȱ仯�Դ�����Ч�ʵ�Ӱ��)��
(1) ��֪�÷�Ӧ��S<0�������������·�Ӧ�ܹ��Է����У���Ӧ�Ħ�H________0(��д��>����<������)��
(2)ǰ2 s�ڵ�ƽ����Ӧ����v(N2)��________��
(3)�ڸ��¶��£���Ӧ��ƽ�ⳣ������ʽK��________��
(4)�������ܱ������з���������Ӧ���ﵽƽ��ʱ���д�ʩ�����NOת���ʵ���________��
A��ѡ�ø���Ч�Ĵ��� B�����߷�Ӧ��ϵ���¶�
C�����ͷ�Ӧ��ϵ���¶� D����С���������
����Ŀ��(1)�����ؽṹ��ͼ���й�������ȷ����_____��ѡ����ţ���
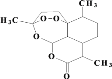
a����ѧʽΪC15H21O5 b��������NaOH��Һ��Ӧ
c��������ˮ d�����й��������н�ǿ������
��������Ϊԭ�ϳ��������岽�ϳɿɵõ������أ����е�2��Ϊ��ԭ��Ӧ��
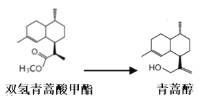
�����¼��ɷ�Ӧ���Է��ȣ���ԭ��ΪLiAlH4��������ʵ����ʣ�
���� | ���� |
˫�����������(C16H28O2) | ���壬������ˮ���������л��ܼ��� |
���ﴼ(C15H28O) | ���壬������ˮ���������л��ܼ��� |
���� | ��ɫҺ�壬����ˮ���ܶ�0.71g/cm3���е�34.6�档 |
�⻯��� | ���壬�������ѡ� ��ˮ��Ӧ��LiAlH4 + 4H2O ��Al(OH)3��+ LiOH +4H2�� �ɽ�һ��������ԭ�ɶ����Ӵ����������ɴ�������ﮡ� ����������﮿������ᷴӦ���������Ρ���κ���Ӧ�Ĵ����� |
ijѧϰС����ʵ������˫�������������ȡ���ﴼ��
(2)��Ӧ��ʹ�ù������⻯��ﮣ�������_____________________________________________��Ϊʹ��Ӧ����Һ״̬�½��У���������Ϊ�ܼ�������ˮ��������____________________��
(3)�����ʵ�����Ʊ�װ�ã�������ͼ����____________
(4)�÷�Ӧ�л����ת����ԼΪ96%������������Һ�к��д�ﮡ�������˫��������������⻯��ﮡ��ӷ�Ӧ���������ȡ���ﴼ�ķ����ǣ�
�ټ�_______���Һ��
�ڴ����Ѳ���ȡ���ﴼ���ж��ַ����������Ƕ��ַ�����
����һ�������ᾧ�� �������������������塣
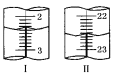
a����2�����������������Ӧ�в���Һ��ԭ����___________________________________��
b�������2���������бȽ�_______________________________________________________��