题目内容
【题目】(1)抽烟对人体有害,烟草不完全燃烧产生的CO被吸进肺里跟血液中的血红蛋白(用Hb表示)化合,发生反应:CO+HbO2![]() O2+HbCO。实验表明,HbCO的浓度即使只有HbO2浓度的2%,也足以使人的智力受损。试回答:
O2+HbCO。实验表明,HbCO的浓度即使只有HbO2浓度的2%,也足以使人的智力受损。试回答:
①上述反应的平衡常数表达式为K=_____________________。
②抽烟后,吸入肺部的空气中测得的CO和O2的浓度分别为10-6 mol·L-1和10-2 mol·L-1。已知37℃时,平衡常数K=220,这时HbCO的浓度__________HbO2浓度的0.02倍(填“大于”“等于”、或“小于”)。
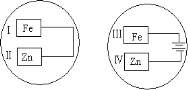
(2)把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图所示。最先观察到酚酞变红的现象的区域是________和__________。(填序号“I”“II”“III”或“IV”)
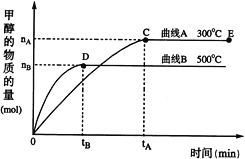
(3)一定条件下,在体积为3 L的密闭容器中,CO与H2反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K=___________,升高温度,K值 ________________。(填“增大”、“减小”或“不变”)。
②在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)=___________________。
③在其他条件不变的情况下,对处于E点的体系体积压缩到原来的![]() ,下列有关该体系的说法正确的是__________
,下列有关该体系的说法正确的是__________
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时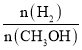 增大
增大
【答案】![]() 大于 I IV
大于 I IV ![]() 减小
减小 ![]() mol/(L·min) bc
mol/(L·min) bc
【解析】
(1)①根据平衡常数=生成物平衡浓度幂次方乘积与反应物平衡浓度幂次方乘积的比;
②利用平衡浓度与平衡常数的关系计算;
(2)根据原电池和电解池的工作原理来确定电极反应、总反应以及电极区域的现象;
(3)①根据方程式和K的含义书写;根据温度对平衡的影响,判断K的变化;
②根据图中甲醇的变化量,求出氢气的变化量,再根据v(H2)=![]() 计算;
计算;
③在其他条件不变的情况下,对处于E点的体系体积压缩到原来的![]() ,则压强增大,正逆反应速率都增大,平衡向正向移动,甲醇的物质的量增多,氢气的物质的量减小,但由于体积减小,平衡时氢气的浓度反而增大,根据浓度比值等于物质的量比值;
,则压强增大,正逆反应速率都增大,平衡向正向移动,甲醇的物质的量增多,氢气的物质的量减小,但由于体积减小,平衡时氢气的浓度反而增大,根据浓度比值等于物质的量比值;
(1)①可逆反应CO+HbO2![]() O2+HbCO的化学平衡常数K=
O2+HbCO的化学平衡常数K=![]() ;
;
②可逆反应CO+HbO2![]() O2+HbCO的化学平衡常数K=
O2+HbCO的化学平衡常数K=![]() =
=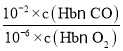 =220,所以
=220,所以![]() =220×10-4=0.022,这时HbCO的浓度>HbO2浓度的0.02倍;
=220×10-4=0.022,这时HbCO的浓度>HbO2浓度的0.02倍;
(2)第一个装置是原电池,Zn为负极,溶液中的O2在Ⅰ处得电子生成OH-,所以Ⅰ处溶液变红色;第二个装置是电解池,铁为阳极,溶液中的H+在Ⅳ处得电子,破坏了锌片附近水的电离平衡,水进一步电离,最终达到平衡时IV附近溶液中OH-浓度增大,所以Ⅳ处溶液变红色,故最先观察到酚酞变红的现象的区域是I和IV;
(3)①对于反应CO(g)+2H2(g)![]() CH3OH(g),化学平衡常数K=
CH3OH(g),化学平衡常数K=![]() ,根据图象可知:CH3OH的平衡时的物质的量300℃>500℃,500℃时甲醇的物质的量小,说明升高温度,化学平衡平衡逆向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,逆反应为吸热反应,所以升高温度, K减小;
,根据图象可知:CH3OH的平衡时的物质的量300℃>500℃,500℃时甲醇的物质的量小,说明升高温度,化学平衡平衡逆向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,逆反应为吸热反应,所以升高温度, K减小;
②在500℃,平衡时图中甲醇的变化量为nB,所以反应消耗的氢气的量为:2nB,则v(H2)=![]() mol/(L·min);
mol/(L·min);
③在其他条件不变的情况下,对处于E点的体系体积压缩到原来的![]() ,则压强增大,物质的浓度都增大,因此正、逆反应速率都增大,由于该反应的正反应为气体体积减小的反应,增大压强,化学平衡向正反应方向移动,使甲醇的物质的量增多,氢气的物质的量减小,但由于体积减小,平衡时氢气的浓度反而增大,根据浓度比值等于物质的量比值,则重新平衡时
,则压强增大,物质的浓度都增大,因此正、逆反应速率都增大,由于该反应的正反应为气体体积减小的反应,增大压强,化学平衡向正反应方向移动,使甲醇的物质的量增多,氢气的物质的量减小,但由于体积减小,平衡时氢气的浓度反而增大,根据浓度比值等于物质的量比值,则重新平衡时![]() 减小,所以合理选项是bc。
减小,所以合理选项是bc。

【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
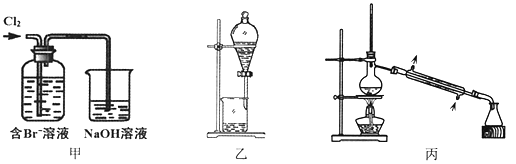
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2