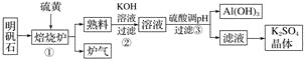
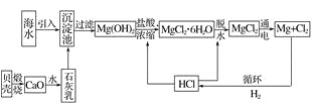
【题目】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及物质未标出)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)===2CO(g)+4H2(g)的ΔH=______________。
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
| 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
①用H2表示前2 h 的平均反应速率v(H2)=_________________________________;
②该温度下,CO2的平衡转化率为________。
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
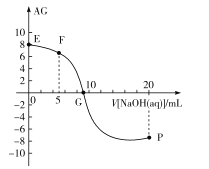
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①该反应的ΔH________0(填“>”或“<”)。
②曲线c表示的物质为_______。
③为提高H2的平衡转化率,除改变温度外,还可采取的措施______________。(答出一条即可)
【题目】已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素。相关信息如下:
X元素是宇宙中最丰富的元素 |
Y元素基态原子的核外p电子数比s电子数少1 |
Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
R元素在元素周期表的第十一列 |
Q元素在周期表里与R元素在同一个分区 |
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是________________,离子化合物YX5的电子式是_________。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是________个。
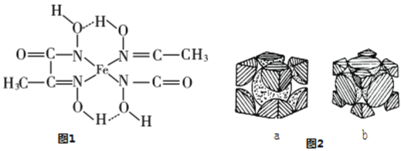
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐)。A晶体的晶胞为正方体(如图)。
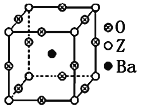
①制备A的化学方程式是_________________________________________;
②在A晶体中,Z的配位数为_______________;
③在A晶体中,若将Z元素置于立方体的体心,Ba元素置于立方体的顶点,则O元素处于立方体的______________。
(4)R2+离子的外围电子层电子排布式为______________。R2O的熔点比R2S的________(填“高”或“低”)。
(5)Q元素和硫(S)元素能够形成化合物B。B晶体的晶胞为正方体(如图),若晶胞棱长为540.0 pm,则晶胞密度为___________________________g·cm3(列式并计算)。
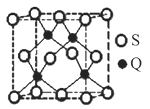 。
。
【题目】(1)实验测得16g甲醇[CH3OH(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇燃烧热的热化学方程式:_______________________.
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程.已知反应:N2(g)+3H2(g)2NH3(g)△H=a kJmol﹣1.有关键能数据如表:
化学键 | H-H | N-H | N≡N |
键能(kJ/mol) | 436 | 391 | 945 |
试根据表中所列键能数据估算a的数值_______________.
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.已知:
C(s,石墨)+O2(g)═CO2(g) △H1=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(l) △H2=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H3=﹣2599kJmol﹣1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的反应热为:△H=____________________.
(4)在微生物作用下,NH4+经过两步反应被氧化成NO3﹣。两步反应的能量变化示意图如图:
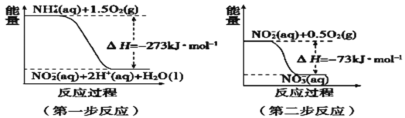
第一步反应是________反应(填“放热”或“吸热”),原因是_________________________