题目内容
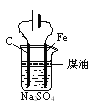
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示:

据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______;写出炉气的一种用途________。
(2)②中Al2O3参与反应的离子方程式为__________。
(3)③中调节pH不能用CO2的理由是____________________。
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________。
(5)纯净氢氧化铝经历两次__________________(填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________。
(6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________%。
【答案】2Al2(SO4)3+3S![]() 2Al2O3+9SO2↑ 用于工业制硫酸 Al2O3+2OH-===2
2Al2O3+9SO2↑ 用于工业制硫酸 Al2O3+2OH-===2![]() +H2O ③中调节pH不能用CO2,因为偏铝酸钾与二氧化碳反应会生成碳酸钾,使制备的K2SO4中有杂质 阳极会产生氧气,阳极的碳块在高温时会与氧气反应 分解反应 Al-3e-+4OH-===
+H2O ③中调节pH不能用CO2,因为偏铝酸钾与二氧化碳反应会生成碳酸钾,使制备的K2SO4中有杂质 阳极会产生氧气,阳极的碳块在高温时会与氧气反应 分解反应 Al-3e-+4OH-===![]() +2H2O 8
+2H2O 8
【解析】
根据题中工业流程可知,明矾石与硫在加热的条件下生成二氧化硫和氧化铝,所以炉气中主要有二氧化硫,熟料中主要是氧化铝,氧化铝溶解在氢氧化钾溶液中,得到偏铝酸钾溶液,用稀硫酸调节PH值,可得氢氧化铝沉淀和硫酸钾溶液,从硫酸钾溶液中可得硫酸钾晶体,据此答题。
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,反应的化学方程式为2Al2(SO4)3+3S![]() 2Al2O3+9SO2,炉气的主要成份是二氧化硫,其一种用途为用于工业制硫酸,故答案为:2Al2(SO4)3+3S
2Al2O3+9SO2,炉气的主要成份是二氧化硫,其一种用途为用于工业制硫酸,故答案为:2Al2(SO4)3+3S![]() 2Al2O3+9SO2;用于工业制硫酸;
2Al2O3+9SO2;用于工业制硫酸;
(2)反应②为Al2O3与氢氧化钾的反应,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)③中调节pH不能用CO2,因为偏铝酸钾与二氧化碳反应会生成碳酸钾,使制备的K2SO4中有杂质,故答案为:偏铝酸钾与二氧化碳反应会生成碳酸钾,使制备的K2SO4中有杂质;
(4)工业冶炼金属铝是用电解熔融的氧化铝的方法,阳极会产生氧气,阳极的碳块在高温时会与氧气反应,所以要定期更换补充阳极碳块,
故答案为:阳极会产生氧气,阳极的碳块在高温时会与氧气反应;
(5)纯净氢氧化铝经过受热分解,再电解可制得铝,涉及的反应类型都是分解反应,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,充当电池的正极,铝发生氧化反应充当电池的负极,所以电池负极的电极反应式是Al-3e-+4OH-=AlO2-+2H2O,故答案为:分解反应;Al-3e-+4OH-=AlO2-+2H2O;
(6)现有明矾石1625t,按上述流程制得780tAl(OH)3,根据明矾石的化学式K2SO4Al2(SO4)32Al2O36H2O可知,明矾石中铝元素与钾元素的物质的量之比为3:1,780tAl(OH)3中铝元素的物质的量为![]() ×106mol=1×107mol,所以钾元素的物质的量为
×106mol=1×107mol,所以钾元素的物质的量为![]() ×107mol,根据元素守恒可知,明矾石中钾元素的质量分数为
×107mol,根据元素守恒可知,明矾石中钾元素的质量分数为 =0.08=8%,故答案为:8。
=0.08=8%,故答案为:8。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:反应Ⅰ N2(g)+O2(g)=2NO(g) ΔH=a kJ·mol-1
反应Ⅱ 2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
反应Ⅲ 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
①写出NO2和NH3反应生成N2和液态水的热化学反应方程式______。
②反应Ⅰ中各物质所含化学键键能总和数据如下表,a=______。
物质 | N2 | O2 | NO |
每摩尔物质所含键能总和/kJ·mol-1 | 946 | 498 | 630 |
(2)用次氯酸钠除去氨氮的原理如图所示。该图示的总反应化学方程式为______。

(3)某微生物膜技术能利用电解原理将弱碱性水中的NO![]() 还原为N2,工作原理如图所示。
还原为N2,工作原理如图所示。

①写出阴极的电极反应式:______。
②理论上,若除去0.04 mol NO![]() ,阳极生成气体的体积为______。(标准状况)
,阳极生成气体的体积为______。(标准状况)