题目内容
【题目】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及物质未标出)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)===2CO(g)+4H2(g)的ΔH=______________。
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
| 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
①用H2表示前2 h 的平均反应速率v(H2)=_________________________________;
②该温度下,CO2的平衡转化率为________。
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①该反应的ΔH________0(填“>”或“<”)。
②曲线c表示的物质为_______。
③为提高H2的平衡转化率,除改变温度外,还可采取的措施______________。(答出一条即可)
【答案】-71.4 kJ·mol-1 0.225 mol·L-1·h-1 40% ![]() < C2H4 加压(或不断分离出水蒸气)
< C2H4 加压(或不断分离出水蒸气)
【解析】
(1)利用燃烧热写出热化学方程式,再根据盖斯定律计算得到所需热化学方程式;
(2)①反应速率v=![]() 计算得到;
计算得到;
②反应物转化率=![]() ×100%;
×100%;
(3)三段式列式计算平衡时气体物质的量,压强之比等于气体物质的量之比,计算得到各气体的分压,结合平衡常数概念计算;
(4)①由图可知,升高温度,氢气物质的量增大,说明平衡逆向移动,则正反应是放热反应;
②升高温度平衡逆向移动,a曲线随着温度升高,物质的量增大,为二氧化碳,b、c随着温度升高其物质的量降低,为生成物水、乙烯,但水的变化量大于乙烯;
③为提高H2的平衡转化率,除改变温度外,还可采取的措施是增大压强。
(1)在101kPa下,CH4、CO、H2的燃烧热(△H)分别为890.3kJ/mol、283kJ/mol、285.8kJ/mol,它们的热化学反应方程式分别为:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=890.3kJ/mol;
②CO(g)+![]() O2(g)═CO2(g)△H=283kJ/mol;
O2(g)═CO2(g)△H=283kJ/mol;
③H2(g)+![]() O2(g)═H2O(l)△H=285.8kJ/mol;
O2(g)═H2O(l)△H=285.8kJ/mol;
根据盖斯定律,由①×2②×2③×4得2CH4(g)+O2(g)═2CO(g)+4H2(g)△H═[(890.3kJ/mol×2)(283kJ/mol)×2](285.8kJ/mol×4)=71.4kJ/mol;
(2)①设反应的二氧化碳物质的量为x,气体压强之比等于气体物质的量之比,
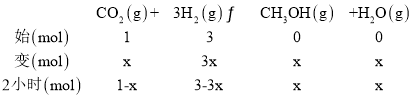
P后:P前=(42x):(1+3) =0.85,解得:x=0.3mol,则用氢气表示前2小时反应平均速率v(H2)=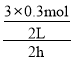 =0.225mol/(Lh);
=0.225mol/(Lh);
②反应达到平衡状态时,二氧化碳反应物质的量为y,
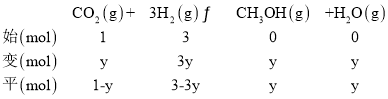
P后:P前=(42y):(1+3) =0.8,解得:y=0.4mol该温度下CO2的平衡转化率=![]() ×100%=40%;
×100%=40%;
(3)若反应条件为压强8MPa,300℃的反应温度下二氧化碳和氢气按1:3的比例通入,测得二氧化碳的平衡转化率为50%,结合三段式列式计算,

分压=总压×物质的量分数,物质的量分数=![]() ,故P(CO2)=
,故P(CO2)=![]() ,P(H2)=
,P(H2)=![]() ,P(CH3OH)=
,P(CH3OH)=![]() ,P(H2O)=
,P(H2O)=![]() Kp=
Kp=![]() =
=![]() (MPa)2;
(MPa)2;
(4)①由图可知,升高温度,氢气物质的量增大,说明平衡逆向移动,则正反应是放热反应,故△H<0;
②根据图知,升高温度,氢气物质的量增大,说明平衡逆向移动,则正反应是放热反应;a曲线随着温度升高,物质的量增大,为二氧化碳,b、c随着温度升高其物质的量降低,为生成物水、乙烯,但水的变化量大于乙烯,所以c曲线代表C2H4;
③由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,该反应为气态分子数减小的反应,为提高H2的平衡转化率,除改变温度外,还可采取的措施是增大压强,或不断分离出水,平衡向右移动,H2的平衡转化率增大。

 阅读快车系列答案
阅读快车系列答案【题目】已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素。相关信息如下:
X元素是宇宙中最丰富的元素 |
Y元素基态原子的核外p电子数比s电子数少1 |
Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
R元素在元素周期表的第十一列 |
Q元素在周期表里与R元素在同一个分区 |
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是________________,离子化合物YX5的电子式是_________。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是________个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐)。A晶体的晶胞为正方体(如图)。
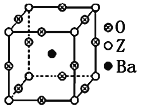
①制备A的化学方程式是_________________________________________;
②在A晶体中,Z的配位数为_______________;
③在A晶体中,若将Z元素置于立方体的体心,Ba元素置于立方体的顶点,则O元素处于立方体的______________。
(4)R2+离子的外围电子层电子排布式为______________。R2O的熔点比R2S的________(填“高”或“低”)。
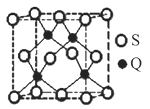
(5)Q元素和硫(S)元素能够形成化合物B。B晶体的晶胞为正方体(如图),若晶胞棱长为540.0 pm,则晶胞密度为___________________________g·cm3(列式并计算)。
 。
。