题目内容
【题目】(1)实验测得16g甲醇[CH3OH(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇燃烧热的热化学方程式:_______________________.
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程.已知反应:N2(g)+3H2(g)2NH3(g)△H=a kJmol﹣1.有关键能数据如表:
化学键 | H-H | N-H | N≡N |
键能(kJ/mol) | 436 | 391 | 945 |
试根据表中所列键能数据估算a的数值_______________.
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.已知:
C(s,石墨)+O2(g)═CO2(g) △H1=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(l) △H2=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H3=﹣2599kJmol﹣1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的反应热为:△H=____________________.
(4)在微生物作用下,NH4+经过两步反应被氧化成NO3﹣。两步反应的能量变化示意图如图:
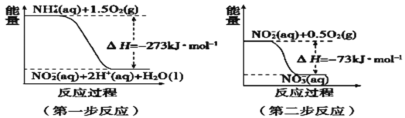
第一步反应是________反应(填“放热”或“吸热”),原因是_________________________
【答案】CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=726.5kJ/mol -93 +226.7 kJmol﹣1 放热 反应物总能量高于生成物总能量
O2(g)=CO2(g)+2H2O(l) △H=726.5kJ/mol -93 +226.7 kJmol﹣1 放热 反应物总能量高于生成物总能量
【解析】
(1)燃烧热是1mol可燃物完全燃烧生成温度氧化物放出的热量,根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)反应热等于反应物的总键能-生成物的总键能求算;(3)可以先根据反应物和生成物书写化学方程式,根据盖斯定律计算反应的焓变,最后根据热化学方程式的书写方法来书写热化学方程式;
(4)当反应物的总能量大于生成物的总能量,反应是放热的。
(1)16gCH3OH在氧气中燃烧生成CO2和液态水,放出363.25kJ热量,32g即1molCH3OH在氧气中燃烧生成CO2和液态水,放出726.5kJ热量,则△H=726.5kJ/mol,则燃烧热的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=726.5kJ/mol,故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) △H=726.5kJ/mol,故答案为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=726.5kJ/mol;
O2(g)=CO2(g)+2H2O(l) △H=726.5kJ/mol;
(2)N2(g)+3H2(g)2NH3(g)△H=945+436×3-391×6 kJmol﹣1=-93 kJmol﹣1,因此a=93,故答案为:93;
(3)已知:①C(s,石墨)+O2(g)═CO2(g) △H1=﹣393.5kJmol﹣1 ②2H2(g)+O2(g)═2H2O(l) △H2=﹣571.6kJmol﹣1 ③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H3=﹣2599kJmol﹣1 ,2C(s,石墨)+H2(g)=C2H2(g)的反应热可以根据①×2+②×![]() ③×
③×![]() 得到,△H=2×(393.5 kJmol﹣1)+(571.6 kJmol﹣1)×
得到,△H=2×(393.5 kJmol﹣1)+(571.6 kJmol﹣1)×![]() (2599 kJmol﹣1)×
(2599 kJmol﹣1)×![]() =+226.7 kJmol﹣1,故答案为:+226.7 kJmol﹣1;
=+226.7 kJmol﹣1,故答案为:+226.7 kJmol﹣1;
(4)因为△H=273kJ/mol<0,则反应为放热反应,反应物的总能量大于生成物的总能量,
故答案为:放热,反应物总能量高于生成物总能量。

 全能测控期末小状元系列答案
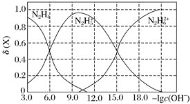
全能测控期末小状元系列答案【题目】25 ℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
(1)HSO![]() 的电离平衡常数表达式K=______________________________。
的电离平衡常数表达式K=______________________________。
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______________。