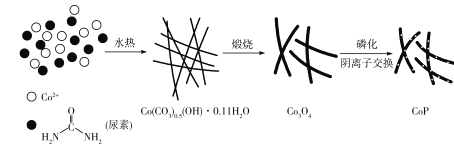
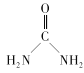
题目内容
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法.
该法的工艺流程为:
其中第①步存在平衡2CrO42(黄色)+2H+Cr2O32(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色.
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72和CrO42的浓度相同
B.2v(Cr2O72)=v(CrO42)
C.溶液的颜色不变
(3)第②步中,还原1molCr2O72离子,需要______mol的FeSO47H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______.
方法2:电解法.
该法用Fe做电极电解含Cr2O72的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生
Cr(OH)3沉淀.
(5)用Fe做电极的原因为______(用电极反应式解释).
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______.
【答案】橙 C 6 5 阳极反应为Fe2e═Fe2+,提供还原剂Fe2+ Fe(OH)3
【解析】
(1)溶液显酸性,c(H+)较大,上述平衡右移,该溶液显橙色;综上所述,本题答案是:橙。
(2)A.Cr2O72和CrO42的浓度相同时,反应不一定达到平衡状态,错误;
B.2v(Cr2O72)=v(CrO42),没有标出正逆反应速率,无法判定反应是否达到平衡状态,错误;
C.平衡时各物质的浓度不再改变,即溶液的颜色不再改变,可以判断反应达到平衡状态,正确;综上所述,本题选C。
(3)根据电子得失守恒可以知道,还原1molCr2O72离子,得到Cr3+,得到电子:2×(6-3)=6mol,Fe2+被氧化为Fe3+,需要FeSO47H2O的物质的量为6/(3-2)=6mol;综上所述,本题答案是:6。
(4)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=![]() =10-9mol/L,C(H+)=10-14/10-9=10-5mol/L, pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5;综上所述,本题答案是:5。
=10-9mol/L,C(H+)=10-14/10-9=10-5mol/L, pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5;综上所述,本题答案是:5。
(5)用Fe做阳极,发生氧化反应,失电子:Fe2e-=Fe2+,产生的亚铁离子做还原剂;综上所述,本题答案是:Fe2e-=Fe2+,提供还原剂Fe2+。
(6)溶液中氢离子在阴极得电子被还原为氢气,阴极极反应为:2H++2e-=H2↑,溶液酸性减弱,溶液pH升高,亚铁离子被氧化为铁离子,酸性减弱,铁离子产生沉淀Fe(OH)3;综上所述,本题答案是:Fe(OH)3。