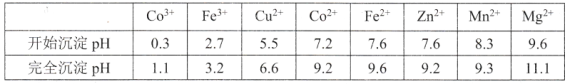
题目内容
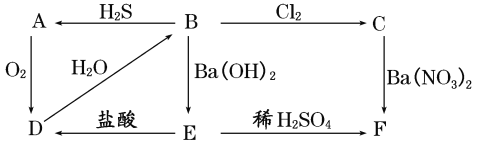
【题目】工业上从海水中提取镁的流程如图所示,据此回答下列问题:
(1)在沉淀池中加入石灰乳的作用是__。
(2)生产过程中,过滤得到的Mg(OH)2沉淀中混有少量Ca(OH)2,实验室中除去Mg(OH)2沉淀中混有的少量Ca(OH)2的方法:先将沉淀加入到盛有__溶液的烧杯中,充分搅拌后经___(填操作方法,下同)、__、__,即可得到纯净的Mg(OH)2。
(3)下列关于题述流程中海水提镁的说法不正确的是__(填字母)。
A.此法的优点之一是原料来源丰富
B.副产品可用于氯碱工业
C.电解时会产生氯气
D.该流程中涉及的化学反应有分解反应、化合反应和置换反应
(4)电解无水氯化镁(熔融态)所得的镁蒸气在特定环境中冷却后可得到固体金属镁,则下列物质可用作镁蒸气的冷却剂的是___(填序号)。
A.H2 B.N2 C.空气 D.O2 E.水蒸气
(5)在SO2中点燃的镁条像在CO2中那样继续燃烧,但反应较镁和CO2反应更为剧烈,反应结束后,在盛有SO2的广口瓶中可能存在的物质是___(写化学式),反应的化学方程式为__、__。
【答案】使Mg2+转化为Mg(OH)2沉淀 MgCl2(或氯化镁) 过滤 洗涤 干燥 D A MgO、MgS 2Mg+SO2![]() 2MgO+S Mg+S
2MgO+S Mg+S![]() MgS
MgS
【解析】
从海水中提取镁的基本原理:将贝壳煅烧得到生石灰,并将生石灰制成石灰乳;将石灰乳加入沉淀池中使Mg2+转化为Mg(OH)2沉淀;在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液;在一定条件下蒸发MgCl2溶液得到无水MgCl2;电解熔融氯化镁可得到Mg。要除去Mg(OH)2沉淀中混有的少量Ca(OH)2,可加入过量MgCl2溶液,使Ca(OH)2中的OH-完全转化为Mg(OH)2沉淀,经过滤、洗涤、干燥,即可得到纯净的Mg(OH)2沉淀。镁的还原性较强,能与N2、空气中的O2、水蒸气反应,故冷却镁蒸气只能选用不与镁反应的H2。
联想镁和CO2的反应,镁能够在CO2中剧烈燃烧生成氧化镁和碳,镁置换出CO2中的C。然后将此反应迁移到镁和SO2的反应中来,镁置换出SO2中的S,生成的S还能与镁反应生成MgS,这就不同于镁和CO2的反应。
(1)在沉淀池中加入石灰乳的作用是使Mg2+转化为Mg(OH)2沉淀。故答案为:使Mg2+转化为Mg(OH)2沉淀;
(2)实验室中除去Mg(OH)2沉淀中混有的少量Ca(OH)2的方法:先将沉淀加入到盛有MgCl2(或氯化镁)溶液的烧杯中,充分搅拌后经过滤、洗涤、干燥,即可得到纯净的Mg(OH)2。故答案为:MgCl2(或氯化镁);过滤、洗涤、干燥;
(3)关于题述流程中海水提镁的说法:
A.利用海水、贝壳,原料来源丰富,故A正确;
B.副产品氯气可用于氯碱工业,故B正确;
C.电解氯化镁时会产生镁和氯气,故C正确;
D.该流程中涉及的化学反应有分解反应如电解氯化镁、化合反应如氧化钙和水反应,没有置换反应,故D错误;
故选D。
(4)电解无水氯化镁(熔融态)所得的镁蒸气在特定环境中冷却后可得到固体金属镁,可用作镁蒸气的冷却剂的是氢气,N2、空气、O2 、水蒸气均能将镁氧化。
故选A。
(5)镁置换出SO2中的S,生成的S还能与镁反应生成MgS,反应结束后,在盛有SO2的广口瓶中可能存在的物质是MgO、MgS,反应的化学方程式为2Mg+SO2![]() 2MgO+S 、Mg+S
2MgO+S 、Mg+S![]() MgS。
MgS。
故答案为:MgO、MgS;2Mg+SO2![]() 2MgO+S 、 Mg+S
2MgO+S 、 Mg+S![]() MgS。
MgS。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】化学与生产、生活密切相关。下列有关物质的用途、性质都正确且有相关性的是
选项 | 用途 | 性质 |
A | 液氨作制冷剂 | NH3分解生成N2和H2的反应是吸热反应 |
B | NH4Fe(SO4)2·12H2O常作净水剂 | NH4Fe(SO4)2·12H2O具有氧化性 |
C | 漂粉精可以作环境消毒剂 | 漂粉精溶液中ClO-和HClO都有强氧化性 |
D | Al2O3常作耐高温材料 | Al2O3,既能与强酸反应,又能与强碱反应 |
A.AB.BC.CD.D
【题目】下表是室温下,几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):
酸或碱 | 电离常数(Ka或Kb) |
CH3COOH | Ka=1.75×10-5 |
柠檬酸(H3C6H5O7) | Ka1=7.4×10-4 Ka2=1.73×10-5 Ka3=4.0×10-7 |
NH3·H2O | Kb=1.75×10-5 |
请回答下列问题:
(1)用蒸馏水稀释0.1 mol/L的醋酸溶液,下列选项中一定变小的是__________(填字母)。
A.![]()
B.c(H+)
C.c(OH-)·c(H+)
D.![]()
E.![]()
(2)浓度为0.10 mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显_____(填“酸”“碱”或“中”)性,通过计算说明其原因____