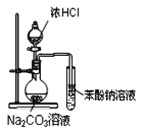
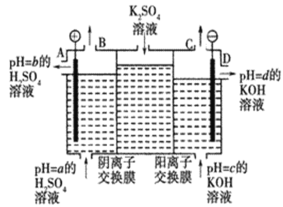
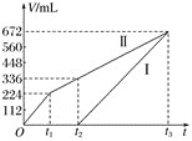
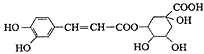0 199225 199233 199239 199243 199249 199251 199255 199261 199263 199269 199275 199279 199281 199285 199291 199293 199299 199303 199305 199309 199311 199315 199317 199319 199320 199321 199323 199324 199325 199327 199329 199333 199335 199339 199341 199345 199351 199353 199359 199363 199365 199369 199375 199381 199383 199389 199393 199395 199401 199405 199411 199419 203614