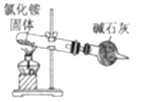
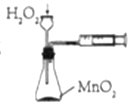
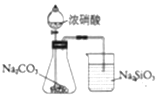
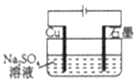
题目内容
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g/cm3的混合溶液。计算(写出计算步骤):
(1)混合后溶液的质量分数;______________
(2)混合后溶液的物质的量浓度;(保留到小数点后一位,下同)___________
(3)在1 000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?__________
【答案】20% 2.3mol·L-1 2.5mol
【解析】
(1)根据ω=![]() ×100%计算出混合后溶液的质量分数;
×100%计算出混合后溶液的质量分数;
(2)根据c=![]() 计算出混合后溶液的物质的量浓度;
计算出混合后溶液的物质的量浓度;
(3)根据(1)中溶液中溶质的质量分数及ω=![]() ,计算出需要硝酸钾的质量,再根据n=
,计算出需要硝酸钾的质量,再根据n=![]() 计算出需要硝酸钾的物质的量。
计算出需要硝酸钾的物质的量。
(1)混合后溶液中的质量为:20.0g+30.0g=50.0g,溶质硝酸钾的质量为:20.0g×14%+30.0g×24%=10.0g,混合后溶液的质量分数:![]() ×100%=20%;
×100%=20%;
(2)混合溶液的体积为:![]() =43.48mL=0.04348L,溶液中溶质的物质的量为:
=43.48mL=0.04348L,溶液中溶质的物质的量为: ![]() =0.099mol,混合后溶液的物质的量浓度为:
=0.099mol,混合后溶液的物质的量浓度为:![]() =2.3mol·L-1;
=2.3mol·L-1;
(3)设需要硝酸钾的物质的量为xmol,硝酸钾的质量为101x,根据(1)可知,硝酸钾的质量分数为20%,则ω=20%=![]() =
=![]() ×100%,解得:x≈2.5mol。
×100%,解得:x≈2.5mol。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D