题目内容
【题目】在废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。已知:25℃H2S电离常数分别为Ka1=1.3×10—7,Ka2=7.0×10—15,某溶液含0.02mol/LMn2+、0.1mol/LH2S,向该溶液中通入HCl气体或加入NaOH固体以调节溶液pH,(忽略溶液体积的变化、H2S的挥发)。当溶液的pH=5时,Mn2+开始沉淀为MnS,则:
(1)HS—的电离常数表达式为______________;
(2)Na2S溶液中的微粒有_____________种;
(3)NaHS溶液的pH_____________7(填“>”、“=”或“<”),理由是__________________;
(4)当溶液的pH=5时,c(S2—)∶c(H2S)=______________;
(5)MnS的溶度积为_____________;
(6)当Mn2+完全沉淀时,溶液中c(S2—)=____________mol/L。
【答案】K2=![]() 7 > HS-的电离平衡常数Ka2=7.0×10-15,其水解平衡常数Kh=
7 > HS-的电离平衡常数Ka2=7.0×10-15,其水解平衡常数Kh=![]() ≈7.7×10-8>Ka2,说明其水解程度大于电离程度,溶液呈碱性 9.1×10—12 1.82×10—14 1.82×10—9
≈7.7×10-8>Ka2,说明其水解程度大于电离程度,溶液呈碱性 9.1×10—12 1.82×10—14 1.82×10—9
【解析】
(1)HS-电离生成硫离子和氢离子;
(2)Na2S溶液中存在S2-的两步水解及水的电离、硫化钠的电离,据此分析判断;
(3)HS-的电离平衡常数Ka2=7.0×10-15,计算出HS-的水解平衡常数Kh,判断Kh与Ka2的大小关系,再分析判断;
(4)![]() =
=![]() ×
×![]() ×
×![]() ×
×![]() =
=![]() ,据此分析计算;
,据此分析计算;
(5)结合(4)的计算分析计算c(S2-),再结合Ksp(MnS)=c(Mn2+)c(S2-)计算;
(6)当Mn2+完全沉淀时,溶液中c(Mn2+)=10-5 mol/L,结合Ksp(MnS)=c(Mn2+)c(S2-)计算。
(1)HS-电离生成硫离子和氢离子,则HS-的电离常数表达式K2=![]() ,故答案为:
,故答案为:![]() ;
;
(2)Na2S溶液中存在S2-的两步水解及水的电离、硫化钠的电离,所以存在微粒有Na+、S2-、HS-、H2S、H+、OH-、H2O,共有7种微粒,故答案为:7;
(3)HS-的电离平衡常数Ka2=7.0×10-15,其水解平衡常数Kh=![]() ≈7.7×10-8>Ka2,说明其水解程度大于电离程度,溶液呈碱性,则溶液的pH>7,故答案为:>;HS-的电离平衡常数Ka2=7.0×10-15,其水解平衡常数Kh=
≈7.7×10-8>Ka2,说明其水解程度大于电离程度,溶液呈碱性,则溶液的pH>7,故答案为:>;HS-的电离平衡常数Ka2=7.0×10-15,其水解平衡常数Kh=![]() ≈7.7×10-8>Ka2,说明其水解程度大于电离程度,溶液呈碱性;
≈7.7×10-8>Ka2,说明其水解程度大于电离程度,溶液呈碱性;
(4)![]() =
=![]() ×
×![]() ×
×![]() ×
×![]() =
=![]() =
=![]() =9.1×10-12,故答案为:9.1×10-12;
=9.1×10-12,故答案为:9.1×10-12;
(5)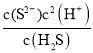 =Ka1×Ka2,溶液的pH=5,则溶液中c(S2-)=
=Ka1×Ka2,溶液的pH=5,则溶液中c(S2-)=![]() ×c(H2S)=
×c(H2S)=![]() ×0.1=9.1×10-13,Ksp(MnS)=c(Mn2+)c(S2-)=0.02×9.1×10-13=1.82×10-14,故答案为:1.82×10-14;
×0.1=9.1×10-13,Ksp(MnS)=c(Mn2+)c(S2-)=0.02×9.1×10-13=1.82×10-14,故答案为:1.82×10-14;
(6)当Mn2+完全沉淀时,溶液中c(Mn2+)=10-5 mol/L,溶液中c(S2-)=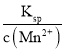 =
=![]() mol/L=1.82×10-9mol/L,故答案为:1.82×10-9。
mol/L=1.82×10-9mol/L,故答案为:1.82×10-9。