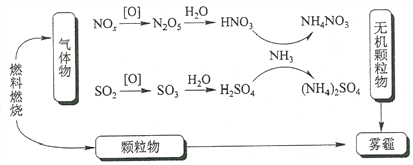
题目内容
【题目】某含铬(Cr2O72-)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmolFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.在FeOFeyCrxO3中,3x=y
B.处理废水中Cr2O72-的物质的量为![]() mol
mol
C.反应中发生转移的电子数为3nxmol
D.消耗硫酸亚铁铵的物质的量为n(2-x)mol
【答案】D
【解析】
A. 反应的Cr元素完全转化为沉淀,根据原子守恒进行计算;
B. Cr2O72-中Cr为+6价,被还原为+3价,每个Cr原子得到3个电子,计算出Cr原子的物质的量,转移的电子的物质的量是原子物质的量的3倍;
C. 根据得失电子守恒进行计算;
D. 由铁元素守恒,求出消耗硫酸亚铁的物质的量,结合得失电子守恒进行计算。
A.FeOFeyCrxO3中,Fe为正三价,由得失电子守恒知3x-y=0,即3x=y, A项正确,不符合题意;
B.根据铬原子守恒,Cr原子为nxmol,故Cr2O72-的物质的量为![]() mol, B项正确,不符合题意;
mol, B项正确,不符合题意;
C.得到nmolFeOFeyCrxO3,则一共有nxmolCr原子参加反应化合价发生变化,1molCr转移电子3mol,故转移的电子数为3nxmol, C项正确,不符合题意;
D.由铁元素守恒,消耗硫酸亚铁铵的物质的量为n(y+1),又由FeOFeyCrxO3电中性知3x+3y=6,代入前式得,消耗硫酸亚铁铵的物质的量为n(3-x);或由得失电子守恒得3x=y,代入得n×(1+y)mol=n×(3x+1)mol, D项错误,符合题意;
答案选D。

【题目】Ⅰ.甲醇是重要的化学工业基础原料和清洁液体燃料,工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)
(2)反应③的ΔS__________0(填“>”、“<”);反应③的ΔH__________0(填“>”、“<”)
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正__________V逆(填“>”、“=”或“<”)
Ⅱ.一定条件下,在容积为2L的密闭容器中充入lmolCO与2molH2合成甲醇,平衡转化率与温度、压强的关系如图所示:
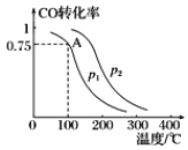
(1)p1__________p2(填“>”、“=”或“<”)。
(2)该反应达到平衡时,反应物转化率的关系是CO____________H2(填“>”、“=”或“<”)。
(3)若100℃P1时达平衡所用的时间为5min,则从开始到平衡这段时间用H2表示的速率为_______________________。
(4)该甲醇合成反应在A点的平衡常数K=___________。