题目内容
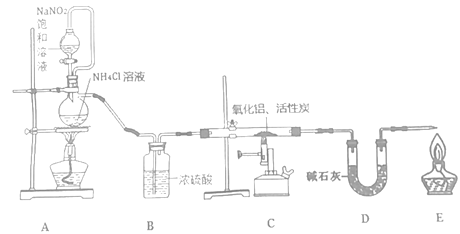
【题目】Ⅰ.某小组运用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液。
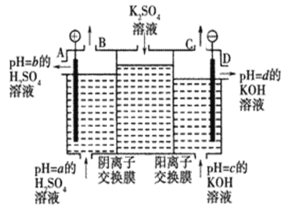
(1)该电解槽的阳极反应式为__________________________________,通过阴离子交换膜的离子数___________(填“>”“<”或“=”)通过阳离子交换膜的离子数
(2)图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为___________
(3)电解一段时间后,B口与C口产生气体的质量比为___________
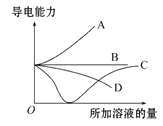
Ⅱ.常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)

(1)曲线___________(填“Ⅰ”或“Ⅱ”)表示阳极产生气体的变化
(2)CuSO4的物质的量浓度为___________mol/L
(3)t1时所得溶液恢复到原来状态需加___________(物质名称)质量___________g
(4)t2时所得溶液的pH为___________
【答案】2H2O—4e—=O2↑+4H+ < b<a<c<d 8:1 Ⅱ 0.1 氯化铜 1.35 1
【解析】
Ⅰ.(1)阳极失电子发生氧化反应,据此书写电极反应方程式;电解硫酸钾溶液,阳极发生氧化反应,OH-被氧化生成O2;SO42-通过阴离子交换膜向阳极移动,钾离子通过阳离子交换膜向阴极移动;
(2)OH-被氧化,阳极生成H+和O2,pH减小,阴极发生还原反应生成H2和OH-,pH增大;
(3)B口生成氧气,C生成氢气。
Ⅱ.刚开始时阴极Cu2+得电子,无气体放出,Cu2+反应完溶液中的H+放电,Ⅰ是H2,阳极先是溶液中的Cl-放电,反应完后溶液中的OH-放电,电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,据此分析解答。
Ⅰ.(1)阳极失电子发生氧化反应,则电极反应式为2H2O-4e-═O2↑+4H+;电解硫酸钾溶液,阳极发生氧化反应,OH-被氧化生成O2,SO42-通过阴离子交换膜向阳极移动,钾离子通过阳离子交换膜向阴极移动,由电荷守恒知硫酸根离子数目小于钾离子数目,故答案为:2H2O-4e-═O2↑+4H+;<;
(2)阳极上阴离子OH-被氧化,pH减小,阴极阳离子氢离子发生还原反应生成H2和OH-,pH增大,则pH为b<a<c<d,故答案为:b<a<c<d;
(3)B口生成氧气,C生成氢气,物质的量之比为1:2,则质量之比为32∶4=8∶1,故答案为:8∶1。
Ⅱ.刚开始时阴极Cu2+得电子,无气体放出,Cu2+反应完溶液中的H+放电,Ⅰ是H2,阳极先是溶液中的Cl-放电,反应完后溶液中的OH-放电,电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑;
(1)通过以上分析知,I表示阴极生成的气体、II表示阳极生成的气体,故答案为:Ⅱ;
(2)Ⅱ曲线中由t1 到t2时生成氧气为112mL,n(O2)=![]() =0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=
=0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=![]() =0.02mol,所以c(CuSO4)=
=0.02mol,所以c(CuSO4)=![]() =0.1mol/L,故答案为:0.1;
=0.1mol/L,故答案为:0.1;
(3)t1时发生2Cl--2e-=Cl2↑,则氯离子减少,故应加入氯化铜可恢复到原来状态;224mL氯气,相当于0.01mol氯气,根据氯元素守恒得 n(CuCl2)=n(Cl2)=0.01mol,则m(CuCl2)=0.01mol×135g/mol=1.35g,故答案为:氯化铜;1.35;
(4)由t2时4OH--4e-=O2↑+2H2O~4H+,n(H+)=0.005mol×4=0.02mol,则溶液的c(H+)=![]() =0.1mol/L,则溶液的pH=1,故答案为:1。
=0.1mol/L,则溶液的pH=1,故答案为:1。