题目内容
【题目】下列说法中正确的是
A.除去苯中的杂质苯酚可加入浓溴水后过滤
B.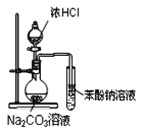 装置可证明酸性:盐酸>碳酸>苯酚
装置可证明酸性:盐酸>碳酸>苯酚
C.乙二酸与足量的酸性KMnO4溶液混合:5H2C2O4 + 2MnO4- + 6H+ =10CO2 ↑ + 2Mn2+ + 8H2O
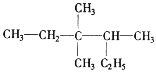
D.鉴别![]() 和
和![]() 只能用金属钠
只能用金属钠
【答案】C
【解析】
A.浓溴水和苯酚反应生成2,4,6-三溴苯酚溶于苯而引入新的杂质,故除去苯中的杂质苯酚不能加浓溴水过滤,A错误;
B.HCl易挥发,能和苯酚钠反应产生苯酚,应在两个装置之间加一个盛放饱和碳酸氢钠的洗气瓶除去HCl,B错误;
C.乙二酸有还原性,酸性高锰酸钾有强氧化性,二者可发生氧化还原反应,离子方程式为:5H2C2O4 + 2MnO4- + 6H+ =10CO2 ↑ + 2Mn2+ + 8H2O,C正确;
D.![]() 没碳碳双键,
没碳碳双键,![]() 有碳碳双键,除Na外,还可用溴水或溴的四氯化碳溶液鉴别,D错误。
有碳碳双键,除Na外,还可用溴水或溴的四氯化碳溶液鉴别,D错误。
答案选C。

练习册系列答案
相关题目