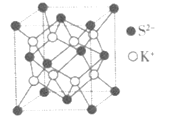
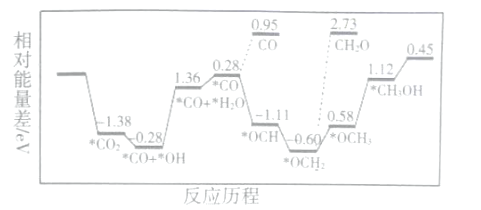
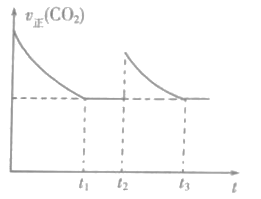
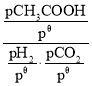【题目】反应速率和化学反应的限度是化学反应原理的重要组成部分。
(1)探究反应条件对0.10 mol/L Na2S2O3溶液与0.10 mol/L稀H2SO4反应速率的影响。反应方程式为:Na2S2O3+H2SO4 = Na2SO4+S↓+SO2↑+H2O。设计测定结果如下:
编号 | 反应温度/℃ | Na2S2O3溶液/mL | 水/mL | H2SO4溶液/mL | 乙 |
① | 25 | 10.0 | 0 | 10.0 | x |
② | 25 | 5.0 | a | 10.0 | y |
③ | 40 | 10.0 | 0 | 10.0 | z |
若上述实验①②是探究浓度对化学反应速率的影响,则a为______,乙是实验需要测量的物理量,则表格中“乙”为________________________,x、y、z的大小关系是_______________________。
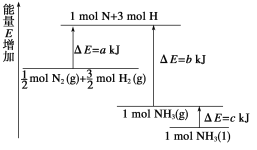
(2)氨气具有广泛的用途,工业上合成氨的反应是N2(g) +3H2(g) ![]() 2NH3(g)
2NH3(g)
①已知:
化学键 | H—H | N≡N | N—H | 键能kJ/mol(断开1mol化学键所需要的能量) | 436 | 945 | 391 |
则合成氨的热化学方程式是__________________________________________________。
②一定温度下,在一个容积固定的密闭容器中若反应起始时N2、H2、NH3的浓度分别为0.1 mol/L、0. 3 mol/L、0.1 mol/L,达到平衡时NH3浓度c(NH3)的范围是________________________。
③ 下列说法中,能说明上述②中反应已经达到化学平衡状态的是_________________。
a. 1mol N≡N键断裂的同时,有6mol N-H键断裂 b. N2、NH3物质的量浓度不再改变 c. 容器中气体的密度保持不变 d. 容器内N2、 H2物质的量之比为1:3,且保持不变 e. 2 v正(NH3)=3 v逆 (H2)
④在工业生产中,及时分离出NH3,有利于合成氨,用平衡移动原理解释原因是_______________________。