题目内容
【题目】A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
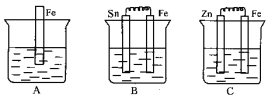
(1)A中反应的离子方程式为_________________________________。
(2)B中Fe极为_______极,电极反应式为_______________________。C中Fe极为_______极,电极反应式为__________________________,电子从_______极流出(填“Zn”或“Fe”)。
(3)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是___________________。
【答案】Fe+2H+=Fe2+H2↑ 负极 Fe-2e-=Fe2+ 正极 2H++2e-=H2↑ Zn B>A>C
【解析】
已知金属活动性:Zn>Fe>Sn,则A发生化学腐蚀,铁与硫酸反应生成硫酸亚铁和氢气,B中Fe为负极,Sn为正极,Fe被腐蚀,C中Zn为负极,Fe为正极,Fe被保护,以此解答。
(1)铁与硫酸反应的离子方程式为:Fe+2H+=Fe2++H2↑;
(2)Fe比Sn活泼,则B中Fe为负极,Sn为正极,负极发生Fe-2e- = Fe2+;Zn比Fe活泼,则C中Fe为正极,Zn为负极,正极反应式为2H++2e-=H2↑,电子从负极即Zn极流出;
(3)A发生化学腐蚀;B中Fe为负极,Sn为正极,Fe被腐蚀;C中Zn为负极,Fe为正极,Fe被保护,Zn被腐蚀,则A、B、C中铁被腐蚀的速率,由快到慢的顺序是B>A>C,。

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目