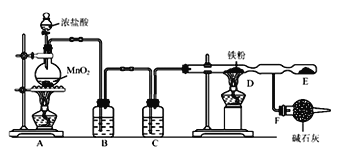
题目内容
【题目】回答下列问题:
(1)已知两种同素异形体A、B的热化学方程式为:A(s)+O2(g)═CO2(g)△H=﹣393.51 kJ·mol-1;B(s)+O2(g)═CO2(g)△H=﹣395.41 kJ·mol-1则两种同素异形体中较稳定的是(填“A”或“B”)______。
(2)已知化学反应N2+3H2![]() 2NH3的能量变化如图所示。
2NH3的能量变化如图所示。
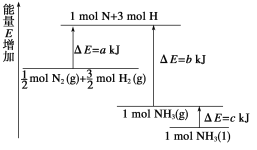
①1 mol N和3 mol H生成1 mol NH3(g)是_______能量的过程(填“吸收”或“释放”)。由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)___________ kJ能量。(用图中字母表示,②同)
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)___________ kJ能量。(用图中字母表示,②同)
②![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)反应生成1 mol NH3(l)的△H = _______________。
mol H2(g)反应生成1 mol NH3(l)的△H = _______________。
(3)工业上用H2和Cl2反应制HCl,各键能为:H﹣H:436 kJ·mol-1,Cl﹣Cl:243 kJ·mol-1,H﹣Cl:431 kJ·mol-1。该反应的热化学方程式是_______________。
【答案】A 释放 释放 b-a △H = -(b+c-a)kJ·mol-1 H2(g)+Cl2(g)=2HCl(g) △H=-183 kJ·mol-1
【解析】
(1)由①A(s)+O2(g)═CO2(g)△H=-393.51kJ/mol;②B(s)+O2(g)═CO2(g)△H=-395.41kJ/mol,根据盖斯定律:①-②分析反应的热效应,能量越高越不稳定;
(2)①原子结合为分子过程会放热;由图象可知,反应物的总能量大于生成物的总能量,反应放热;△H=生成物的活化能-反应物的活化能;
②根据反应热等于反应物总能量减去生成物总能量计算反应热并书写热化学方程式,注意反应物的物质的量和生成物的聚集状态;
(3)反应方程式为:H2+Cl2=2HCl,根据吸收的能量之和与放出的能量之和的相对大小判断反应的吸放热,二者的差值即为焓变的数值。
(1)由①A(s)+O2(g)═CO2(g)△H=-393.51kJ/mol;②B(s)+O2(g)═CO2(g)△H=-395.41kJ/mol,根据盖斯定律:①-②得:A(s)=B(s)△H>0,所以B的能量高,能量越高越不稳定,A稳定;
(2)①原子结合为分子过程会放热,所以1mol N和3mol H生成1mol NH3(g)是释放能量的过程;由图象可知,反应物的总能量大于生成物的总能量,则该反应为放热反应,则![]() molN2(g)和
molN2(g)和![]() molH2(g)生成1mol NH3(g)过程时放热过程;△H=生成物的活化能-反应物的活化能=b-akJ/mol,所以1mol NH3(g)过程时放热b-akJ;
molH2(g)生成1mol NH3(g)过程时放热过程;△H=生成物的活化能-反应物的活化能=b-akJ/mol,所以1mol NH3(g)过程时放热b-akJ;
②![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)反应生成1 mol NH3(l)的△H =(akJmol-1)-(b kJmol-1+c kJmol-1)= -(b+c-a)kJmol-1;
mol H2(g)反应生成1 mol NH3(l)的△H =(akJmol-1)-(b kJmol-1+c kJmol-1)= -(b+c-a)kJmol-1;
(3)反应方程式为:H2+Cl2=2HCl,生成2molHCl,需吸收能量:436kJ+243kJ=679kJ,放出能量:2×431kJ=862kJ,放出的能量大于吸收的能量,则该反应放热,焓变为负号,且放出的热量为:864kJ-679kJ=185kJ,所以△H=-183KJ/mol,所以反应的热化学方程式是H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ/mol。