题目内容
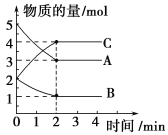
【题目】工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
‘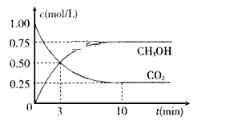
(1)该密闭容器的容积是______________L。
(2)达到平衡状态的时刻是_______________min(填“3”或“10”)。
(3)在前10min内,用CO2浓度的变化表示的反应速率![]() (CO2)=_____________mol/(L·min)。
(CO2)=_____________mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为______。
(5)该温度下,反应的化学平衡常数数值是____。
(6)已知: ① CO(g)+2H2(g) ![]() CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g)
CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g) ![]() CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_____,反应在10 min内所放出的热量为_____kJ.
CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_____,反应在10 min内所放出的热量为_____kJ.
【答案】2 10 0.075 5:8 5.3 CO2(g)+ 3H2 (g)= CH3OH(g) ΔH=-49kJ/mol 73.5
【解析】
(1)图示起始时CO2的物质的量为2 mol,浓度为1mol/L,结合c=![]() 计算容器的体积;
计算容器的体积;
(2)当各物质的浓度不再随时间的变化而变化时,反应处于平衡状态;
(3)根据v=![]() 计算反应速率;
计算反应速率;
(4)恒温恒容条件下,容器内压强与气体的物质的量成正比;
(5)平衡常数K=![]() ;
;
(6)已知: ① CO(g)+2H2(g) ![]() CH3OH(g) ΔH= -90.1 kJ·mol-1,②CO(g) +H2O(g)
CH3OH(g) ΔH= -90.1 kJ·mol-1,②CO(g) +H2O(g) ![]() CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,由盖斯定律①-②得CO2(g)+3H2(g)
CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,由盖斯定律①-②得CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),则可计算△H和平衡时反应放出的热量。
CH3OH(g)+H2O(g),则可计算△H和平衡时反应放出的热量。
(1)图示起始时CO2的物质的量为2 mol,浓度为1mol/L,则容器的体积V=![]() =
=![]() =2L;
=2L;
(2)当反应进行到10min时,各物质的浓度不再随时间的变化而变化,此时反应处于平衡状态;
(3)平衡时CO2的物质的量浓度0.25mol/L,△c=1mol/L-0.25mol/L=0.75mol/L,则![]() (CO2)==
(CO2)==![]() =
=![]() =0.075 mol/(L·min);
=0.075 mol/(L·min);
(4)由CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)可知平衡时H2的物质的量浓度为
CH3OH(g)+H2O(g)可知平衡时H2的物质的量浓度为![]() -0.75mol/L×3=0.75 mol/L,H2O(g)的浓度为0.75mol/L,结合恒温恒容条件下,容器内压强与气体的物质的量成正比,可知10min时体系的压强与开始时压强之比为
-0.75mol/L×3=0.75 mol/L,H2O(g)的浓度为0.75mol/L,结合恒温恒容条件下,容器内压强与气体的物质的量成正比,可知10min时体系的压强与开始时压强之比为![]() =5:8;
=5:8;
(5)平衡常数K=![]() =
=![]() =5.3;
=5.3;
(6)已知: ① CO(g)+2H2(g) ![]() CH3OH(g) ΔH= -90.1 kJ·mol-1,②CO(g) +H2O(g)
CH3OH(g) ΔH= -90.1 kJ·mol-1,②CO(g) +H2O(g) ![]() CO2(g)+H2(g) ΔH=-41.1 kJ·mol-1,由盖斯定律①-②得CO2(g)+3H2(g)
CO2(g)+H2(g) ΔH=-41.1 kJ·mol-1,由盖斯定律①-②得CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),则此反应的△H=(-90.1 kJ·mol-1)-(-41.1 kJ·mol-1)=ΔH=-49kJ/mol;
CH3OH(g)+H2O(g),则此反应的△H=(-90.1 kJ·mol-1)-(-41.1 kJ·mol-1)=ΔH=-49kJ/mol;
反应在10 min内参加反应的CO2的物质的量为0.75mol/L×2=1.5mol,放出的热量为49kJ/mol×1.5mol=73.5kJ。

【题目】奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满足如图中阴影部分关系的是( )

① | ② | ③ | ④ | |
A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
B | Na2SO4 | K2SO4 | KCl | NH4Cl |
C | NaCl | K2SO4 | KCl | NH4Cl |
D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
A.AB.BC.CD.D