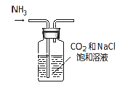
题目内容
【题目】高铁酸钾(K2FeO4)是一种紫黑色固体,只能在碱性环境中稳定存在,在中性或酸性中易分解,工业中通常是先制得高铁酸钠再转化为高铁酸钾。
I.制备NaCIO溶液
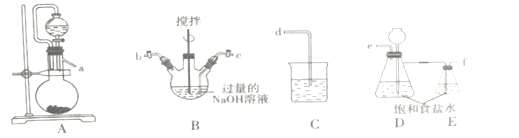
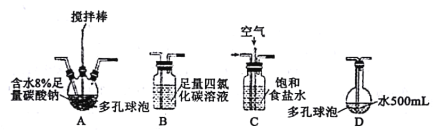
(1)装置的连接顺序为a→___→d。
(2)装置D的作用___。
(3)B装置反应过程中要严格控制温度,温度过高易生成NaClO3,写出生成NaClO3的离子方程式___。
II.制备K2FeO4
(1)湿法制备K2FeO4:将Fe(NO3)3溶液滴加到装置B的混合溶液中,其反应的离子方程式是___。继续向反应后的溶液中加入KOH,会析出紫黑色固体,上述转化能发生的原因是___(用简要的文字说明)。
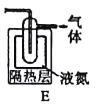
(2)电解法制备K2FeO4(如图):

该装置中离子交换膜为___离子交换膜(填“阴”或“阳"),阳极电极反应式为___。
III.K2FeO4性质的探究
取电解后的溶液滴加稀盐酸,收集到黄绿色气体。针对以上现象,甲乙两位同学提出了以下猜想:
甲:气体只含有Cl2。
乙:气体除Cl2外还含有___,请设计实验证明乙同学的猜测___。
【答案】efcb 储存氯气 3Cl2 + 6OH- ![]() 5Cl- + ClO3-+ 3H2O 2Fe3+ + 3ClO3-+ 10OH-=2FeO42 +3Cl- + 5H2O 相同条件下,K2FeO4的溶解度比Na2FeO4的溶解度小 阴 Fe6e- + 8OH-=FeO42 + 4H2O O2 将所得的气体通入盛有过量的NaOH溶液的洗气瓶中,收集气体用带火星木条检测,若木条复燃,则乙猜测正确
5Cl- + ClO3-+ 3H2O 2Fe3+ + 3ClO3-+ 10OH-=2FeO42 +3Cl- + 5H2O 相同条件下,K2FeO4的溶解度比Na2FeO4的溶解度小 阴 Fe6e- + 8OH-=FeO42 + 4H2O O2 将所得的气体通入盛有过量的NaOH溶液的洗气瓶中,收集气体用带火星木条检测,若木条复燃,则乙猜测正确
【解析】
A装置实验室制氯气,B装置是氯气与NaOH溶液反应生成NaClO溶液,C装置尾气处理,D装置储存氯气,E装置处理HCl气体,B装置在常温下反应生成NaClO溶液,在温度较高条件下生成NaClO3,NaClO3与Fe(NO3)3在碱性条件下反应生成Na2FeO4,Na2FeO4与KOH根据溶解度的大小发生反应生成K2FeO4,利用铁电解在碱性条件下反应得到FeO42,高铁酸钾在中性或酸性中易分解。据此解答。
I.(1)A装置制氯气,先用E装置饱和食盐水除HCl,再用氯气和氢氧化钠反应B装置制取NaClO,再用C装置处理尾气,因此装置的连接顺序为a→e→f→c→b→d;故答案为:efcb。
(2)装置D的作用储存氯气;故答案为:储存氯气。
(3)B装置反应过程中要严格控制温度,温度过高易生成NaClO3,氯气和氢氧化钠加热反应生成NaCl、水和NaClO3,生成NaClO3的离子方程式 3Cl2 + 6OH- ![]() 5Cl- + ClO3-+ 3H2O;故答案为:3Cl2 + 6OH-
5Cl- + ClO3-+ 3H2O;故答案为:3Cl2 + 6OH- ![]() 5Cl- + ClO3-+ 3H2O。
5Cl- + ClO3-+ 3H2O。
II.(1)将Fe(NO3)3溶液滴加到装置B的混合溶液中,反应生成FeO42、Cl-和H2O,其反应的离子方程式是2Fe3+ + 3ClO3-+ 10OH-=2FeO42 +3Cl- + 5H2O。继续向反应后的溶液中加入KOH,会析出紫黑色固体,上述转化能发生的原因是相同条件下,K2FeO4的溶解度比Na2FeO4的溶解度小;故答案为:2Fe3+ + 3ClO3-+ 10OH-=2FeO42 +3Cl- + 5H2O;K2FeO4的溶解度比Na2FeO4的溶解度小。
(2)该装置中铁作阳极电解变为FeO42,Fe 6e- + 8OH- = FeO42 + 4H2O,阴极是2H2O + 2e-= 2OH-+ H2↑,电解池中OH-向左不断移动,因此离子交换膜为阴离子交换膜;故答案为:阴;Fe 6e- + 8OH- = FeO42 + 4H2O。
III.根据题意高铁酸钾在酸性或中性溶液中发生分解反应会产生氧气,加入盐酸除生成氯气外,还可能生成氧气,可将所得的气体通入过量的NaOH溶液的洗气瓶中,收集气体用带火星木条检测,若木条复燃,则乙猜测正确;故答案为:O2;将所得的气体通入过量的NaOH溶液的洗气瓶中,收集气体用带火星木条检测,若木条复燃,则乙猜测正确。

【题目】一定温度(t℃)下,向1 L密闭容器中通入H2和 I2各0.15 mol,发生如下反应: H2(g) + I2(g) ![]() 2HI(g),ΔH<0 一段时间后达到平衡,测得数据如下:
2HI(g),ΔH<0 一段时间后达到平衡,测得数据如下:
t/min | 2 | 4 | 7 | 9 |
n(I2)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
请回答:
(1)反应到第___________分钟达到平衡状态。
(2)2 min内,v(H2) =______________mol/(L·min)。
(3)下列能证明该反应已经达到平衡的是________(填字母)。
a. v正(H2)= v逆 (HI) b. 混合气体的颜色不再发生变化
c. 混合气体中各组分的物质的量不再发生变化 d. 混合气体的密度不再变化。
(4)①该反应的化学平衡常数表达式为_______________。②H2的平衡转化率是__________________。
(5)升高温度,化学平衡常数K要___________(填“变大”或“变小”)。
(6)该温度(t℃)下,若开始通入一定量的H2和 I2,反应达到平衡时,测得c(H2)=0.4mol/L,c(I2)=0.9mol/L,则平衡时c(HI)=______________mol/L.