题目内容
【题目】CO2的资源化利用能有效减少CO2排放,又能缓解能源危机。实现CO2资源化再利用的研究工作正在不断进行中。
(1)CO2和H2,合成CH3OH,用非金属催化剂实现CO2电催化还原制备甲醇的反应历程如图所示:
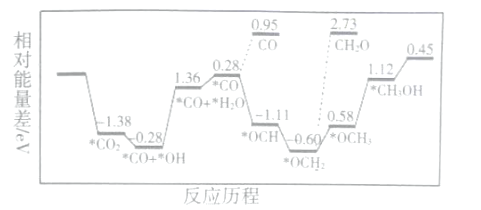
上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中___ (填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C. *OCH2→*OCH3 D.*OCH3→*CH3OH
(2)CO2和H2合成甲酸(HCOOH)其反应为:H2(g)+CO2(g)![]() HCOOH(g)。一定温度下,恒容密闭容器中进行上述反应,测得v正(CO2)随反应时间(t)的变化如图所示。
HCOOH(g)。一定温度下,恒容密闭容器中进行上述反应,测得v正(CO2)随反应时间(t)的变化如图所示。
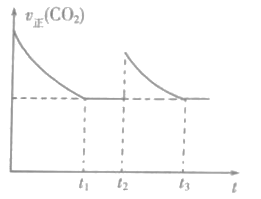
①t2时,改变的条件是充入amolCO2,同时___。
②下列关于t1、t3时刻的说法,正确的是___。
a.平衡常数:K1>K3
b.混合气的平均分子量:![]() <
<![]()
c.混合气中HCOOH的体积分数:V1=V3
③标准平衡常数Kθ=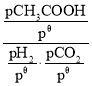 ,其中pθ为标准压强(1×105Pa),pH2、pCO2和pHCOOH为各组分的平衡分压,如pCO2=pxCO2,p为平衡总压,xCO2为平衡系统中CO2的物质的量分数。在标准压强下,向上述容器充入等物质的量的H2和CO2进行反应,测得HCOOH的平衡产率为w,则K=___(用含w字母表示)。
,其中pθ为标准压强(1×105Pa),pH2、pCO2和pHCOOH为各组分的平衡分压,如pCO2=pxCO2,p为平衡总压,xCO2为平衡系统中CO2的物质的量分数。在标准压强下,向上述容器充入等物质的量的H2和CO2进行反应,测得HCOOH的平衡产率为w,则K=___(用含w字母表示)。
(3)O2辅助的Al~CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
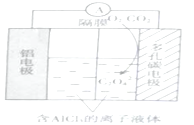
电池正极区发生的反应:①O2+e-=O2-;②___,O2的作用是___。
(4)CH4超干重整CO2得到的CO经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加入一定浓度的KOH溶液,所得溶液的pH=3,则![]() =___。
=___。
(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5)
【答案】A 加入amol H2(g),分离出a molHCOOH c ![]() 2CO2 + 2O2-=C2O42 + 2O2 催化剂 3.6
2CO2 + 2O2-=C2O42 + 2O2 催化剂 3.6
【解析】
(1)上述合成甲醇的反应速率较慢,说明反应中有能量差较大的变化,要使反应速率加快,则主要是降低能量差大的反应过程,根据分析A选项能量差为1.64eV,B选项能量差为1.39eV,C选项能量差为1.18eV,D选项能量差为0.54eV,因此A选项中能量差最大,降低它的变化能加快反应速率,故答案为:A。
(2)①t2时,改变的条件是充入amolCO2,t3时刻正反应速率与t1时刻正反应速率相等,说明两个时刻的物质的量没有发生改变,因此在t2时刻加入amol H2(g)同时移出a molHCOOH;故答案为:加入amol H2(g)同时移出a molHCOOH。
②a. 温度相同,因此平衡常数不变,即K1=K3,故a错误;b. 根据前面分析得到t1、t3时刻物质的量相等,质量也相等,因此混合气的平均分子量:![]() =
= ![]() ,故b错误;c. t1、t3时刻物质的量相等,因此混合气中HCOOH的体积分数相等即V1=V3,故c正确;综上所述,答案为:c。
,故b错误;c. t1、t3时刻物质的量相等,因此混合气中HCOOH的体积分数相等即V1=V3,故c正确;综上所述,答案为:c。
③在标准压强下,向上述容器充入等物质的量的H2和CO2进行反应,
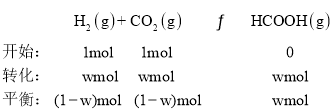
![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() ,
,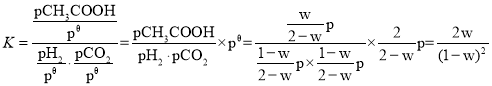 ;
;
故答案为:![]() 。
。
(3)电池正极区发生的反应:①O2 +e-=O2-,②2CO2 +2O2-=C2O42-+2O2,根据这两个方程式加和得到O2参与了化学反应,但量未发生改变,因此O2的作用是催化剂;故答案为:2CO2 +2O2-=C2O42-+2O2;催化剂。
(4)常温下,向某浓度的草酸溶液中加入一定浓度的KOH溶液,所得溶液的pH=3,则![]() ;故答案为:3.6。
;故答案为:3.6。

【题目】下列对实验事实的解释错误的是( )
选项 | 实验事实 | 解释 |
A | 实验室用粗锌与稀盐酸反应制H2比纯锌快 | 粗锌与稀盐酸构成原电池 |
B | 浓硝酸保存在棕色试剂瓶中 | 4HNO3 |
C | 向10mL0.2mol·L-1ZnSO4,溶液中加入10mL0.4mol·L-1Na2S溶液,产生白色沉淀,再滴加CuSO4溶液,沉淀变黑 | Ksp(CuS)<Ksp(ZnS) |
D | 做过银镜反应的试管可用铁盐溶液洗涤,加入稀盐酸,清洗效果更好 | Fe3++Ag |
A.AB.BC.CD.D
【题目】反应速率和化学反应的限度是化学反应原理的重要组成部分。
(1)探究反应条件对0.10 mol/L Na2S2O3溶液与0.10 mol/L稀H2SO4反应速率的影响。反应方程式为:Na2S2O3+H2SO4 = Na2SO4+S↓+SO2↑+H2O。设计测定结果如下:
编号 | 反应温度/℃ | Na2S2O3溶液/mL | 水/mL | H2SO4溶液/mL | 乙 |
① | 25 | 10.0 | 0 | 10.0 | x |
② | 25 | 5.0 | a | 10.0 | y |
③ | 40 | 10.0 | 0 | 10.0 | z |
若上述实验①②是探究浓度对化学反应速率的影响,则a为______,乙是实验需要测量的物理量,则表格中“乙”为________________________,x、y、z的大小关系是_______________________。
(2)氨气具有广泛的用途,工业上合成氨的反应是N2(g) +3H2(g) ![]() 2NH3(g)
2NH3(g)
①已知:
化学键 | H—H | N≡N | N—H | 键能kJ/mol(断开1mol化学键所需要的能量) | 436 | 945 | 391 |
则合成氨的热化学方程式是__________________________________________________。
②一定温度下,在一个容积固定的密闭容器中若反应起始时N2、H2、NH3的浓度分别为0.1 mol/L、0. 3 mol/L、0.1 mol/L,达到平衡时NH3浓度c(NH3)的范围是________________________。
③ 下列说法中,能说明上述②中反应已经达到化学平衡状态的是_________________。
a. 1mol N≡N键断裂的同时,有6mol N-H键断裂 b. N2、NH3物质的量浓度不再改变 c. 容器中气体的密度保持不变 d. 容器内N2、 H2物质的量之比为1:3,且保持不变 e. 2 v正(NH3)=3 v逆 (H2)
④在工业生产中,及时分离出NH3,有利于合成氨,用平衡移动原理解释原因是_______________________。



