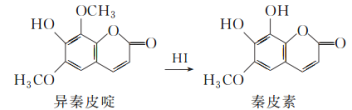
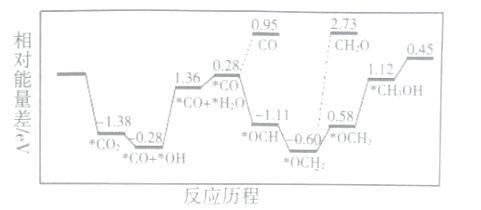
题目内容
【题目】反应速率和化学反应的限度是化学反应原理的重要组成部分。
(1)探究反应条件对0.10 mol/L Na2S2O3溶液与0.10 mol/L稀H2SO4反应速率的影响。反应方程式为:Na2S2O3+H2SO4 = Na2SO4+S↓+SO2↑+H2O。设计测定结果如下:
编号 | 反应温度/℃ | Na2S2O3溶液/mL | 水/mL | H2SO4溶液/mL | 乙 |
① | 25 | 10.0 | 0 | 10.0 | x |
② | 25 | 5.0 | a | 10.0 | y |
③ | 40 | 10.0 | 0 | 10.0 | z |
若上述实验①②是探究浓度对化学反应速率的影响,则a为______,乙是实验需要测量的物理量,则表格中“乙”为________________________,x、y、z的大小关系是_______________________。
(2)氨气具有广泛的用途,工业上合成氨的反应是N2(g) +3H2(g) ![]() 2NH3(g)
2NH3(g)
①已知:
化学键 | H—H | N≡N | N—H | 键能kJ/mol(断开1mol化学键所需要的能量) | 436 | 945 | 391 |
则合成氨的热化学方程式是__________________________________________________。
②一定温度下,在一个容积固定的密闭容器中若反应起始时N2、H2、NH3的浓度分别为0.1 mol/L、0. 3 mol/L、0.1 mol/L,达到平衡时NH3浓度c(NH3)的范围是________________________。
③ 下列说法中,能说明上述②中反应已经达到化学平衡状态的是_________________。
a. 1mol N≡N键断裂的同时,有6mol N-H键断裂 b. N2、NH3物质的量浓度不再改变 c. 容器中气体的密度保持不变 d. 容器内N2、 H2物质的量之比为1:3,且保持不变 e. 2 v正(NH3)=3 v逆 (H2)
④在工业生产中,及时分离出NH3,有利于合成氨,用平衡移动原理解释原因是_______________________。
【答案】5 溶液变浑浊所需时间 y>x>z N2(g) +3H2(g) ![]() 2NH3(g) ΔH=-93kJ/mol 0~0.3 a,b 减小生成物浓度,平衡正向移动
2NH3(g) ΔH=-93kJ/mol 0~0.3 a,b 减小生成物浓度,平衡正向移动
【解析】
(1)Na2S2O3溶液与稀H2SO4反应生成二氧化硫和硫沉淀,当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致,要探究Na2S2O3溶液浓度不同对反应速率的影响,则加入的Na2S2O3溶液的体积不同,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积相同;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短;
(2)①根据反应热等于反应物的总键能-生成物的总键能求算;
②可假设反应正向进行或逆向进行达到平衡,并结合可逆反应的限度来判断即可;
③当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
④勒沙特列原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。
(1)实验①②中的Na2S2O3溶液的加入体积不同,故要探究Na2S2O3溶液浓度不同对反应速率的影响,但溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积相同,故甲应为V(蒸馏水)/mL,a的值为5.0;又Na2S2O3溶液与稀H2SO4反应生成二氧化硫和硫沉淀,则要准确描述反应速率的快慢,必须准确测得溶液出现浑浊时间的长短,故乙要测量的物理量是出现浑浊的时间,温度越高反应速率越快,浓度越大反应速率越快,速率快,出现浑浊的时间短,已经③的温度最高,①的反应物浓度比②大,则反应出现浑浊的时间 是y>x>z;
(2)①已知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)中需要断裂1个N≡N键和3个H-H键,同时形成6个N-H键,则△H=945kJmol-1+436kJmol-1×3-391kJmol-1×6=-93kJmol-1= -93kJmol-1,则合成氨的热化学方程式是N2(g) +3H2(g)
2NH3(g)中需要断裂1个N≡N键和3个H-H键,同时形成6个N-H键,则△H=945kJmol-1+436kJmol-1×3-391kJmol-1×6=-93kJmol-1= -93kJmol-1,则合成氨的热化学方程式是N2(g) +3H2(g) ![]() 2NH3(g) ΔH=-93kJ/mol。
2NH3(g) ΔH=-93kJ/mol。
②若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,假设反应正向进行,则N2的最大转化浓度为0.1mol/L,则NH3的变化浓度为0.2mol/L,即平衡时NH3的浓度小于0.3mol/L,假设反应逆向进行,则NH3的变化浓度最大为0.1mol/L,即平衡时NH3的最小浓度为大于0mol/L,故NH3达到平衡时浓度的范围为0mol/L<c(NH3)<0.3mol/L;
③ a.单位时间内1mol N≡N键断裂等效于6mol N-H键形成,同时6mol N-H键断裂,故a正确;
b.当反应达到平衡状态时,N2、NH3物质的量浓度不再改变,故b正确;
c.反应前后气体质量和体积不变,混合气体的密度始终保持不变,不能说明反应达到平衡状态,故c错误;
d.当体系达平衡状态时,n(N2):n(H2)可能等于1:3,也可能不等于1:3,故d错误;
e.当3v正(NH3)=2v逆 (H2)时,反应达到平衡状态,则2 v正(NH3)=3 v逆 (H2)时反应不是平衡状态,故e错误;
故答案为ab;
④根据勒夏特列原理,分离出生成物,会减小生成物浓度,导致平衡正向移动,有利于氨气的合成。

【题目】Ⅰ.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)该反应的热化学方程式为_______________________________________。
(2)又知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________________________。
Ⅱ.参考下列图表和有关要求回答问题。
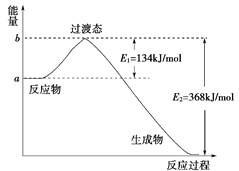
(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________________;
(2)下表是部分化学键的键能数据:
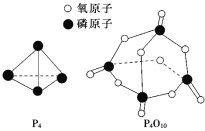
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ/mol) | a | b | c | x |
已知白磷的燃烧热ΔH=-d kJ/mol,白磷及其完全燃烧的产物结构如图所示,则上表中x=______________________(用含有a、b、c、d的代数式表示)。