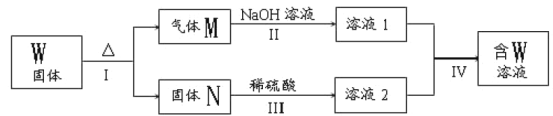
【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

已知:①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3![]() 2NaAlO2+CO;
2NaAlO2+CO;
完成下列填空:
(1)操作Ⅰ在常温下该反应速率极慢,下列措施中能使反应速率增大的是____。
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
(2)固体X中主要含有___(填写化学式)。
(3)操作Ⅳ中有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、___、____、洗涤、干燥。
(4)如表是相关物质的溶解度数据,操作Ⅳ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,该反应在溶液中能发生的理由是____(文字说明)。
物质 | 溶解度(g/100g水) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取![]() 样品,加入过量____(填写试剂)、溶解、过滤、再加入(或通入)____(填写试剂)、……灼烧、冷却、称量,得干燥固体
样品,加入过量____(填写试剂)、溶解、过滤、再加入(或通入)____(填写试剂)、……灼烧、冷却、称量,得干燥固体![]() 。计算样品中氢氧化铝的质量分数为___(用含m、n的代数式表示)。
。计算样品中氢氧化铝的质量分数为___(用含m、n的代数式表示)。
【题目】一定条件下,金属钠和CO2可制得金刚石:4Na+3CO2![]() 2Na2CO3+C(s,金刚石)
2Na2CO3+C(s,金刚石)
完成下列填空:
(1)上述反应中涉及的元素的原子半径从大到小的顺序为____。
(2)能证明碳元素与氧元素非金属强弱的事实是___(选填编号)。
a.最高价氧化物水化物的酸性 b.两种元素的气态氢化物的沸点
c.CO2中元素的化合价 d.气体氢化物受热分解的温度
(3)高压下,科学家成功地将CO2转化为具有类似SiO2结构的原子晶体,比较SiO2与CO2这两种原子晶体的熔沸点高低,并说明理由:___。
常压 | 熔点(℃) | 沸点(℃) |
钠 | 97.8 | 882.9 |
Na2CO3 | 851 | 1850分解 |
金刚石 | 3550 | … |
石墨 | 3850 | 4250 |
(4)若在2L密闭容器中,10min内金属钠减少了0.2mol,则CO2的平均反应速率为___。该反应在常压1000℃下进行,根据右表数据,该反应的平衡常数表达式K=___。
(5)若在2L密闭容器中,常压、1000℃下,起始时,下列物理量能说明该反应已达到平衡状态的是____。
a.气体的平均摩尔质量不变 b.3v消耗(Na)=4v生成(CO2)
c.气体的密度不变 d.![]() 的比值不变
的比值不变