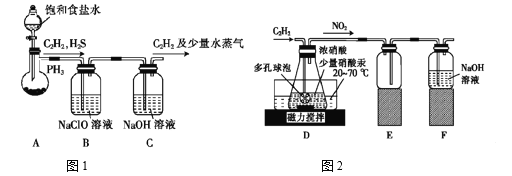
��Ŀ����
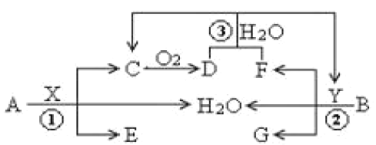
����Ŀ����֪���ֳ�������A(�ؿ��к����ڶ��Ľ���)��B(��ɫ����)�ֱ���������X��Y������Ӧ����ת����ϵ��ͼ��ʾ������DΪ����ɫ���塣
�ش��������⣺
��1����Ӧ�۵����ӷ�Ӧ����ʽΪ___��
��2��6.4gB�����X��Һ(8mol /L��60mL)��ַ�Ӧ�����ɵĻ�ԭ������C��D����Ӧ����Һ������XΪn mol ����ʱ��Һ������X�������ӵ����ʵ���Ϊ___mol��
��3��������A��Y��ϡ��Һ�ܷ�����Ӧ������W�����ڹ���W��ת����ϵ��ͼ��ʾ(����������ȥ)������N�Ǻ���ɫ�Ļ����
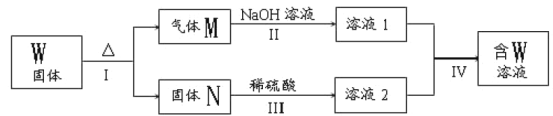
��M�����ֻ�������ɣ����к��Уƣ�����ͨ��BaCl2��Һ��ʵ��������___��
��������ӦI�õ�16 g����Σ�����������Mǡ�ñ�0.3L1mol��L��1 NaOH��Һ��ȫ���յ���Һ1����Ӧ���з�����Ӧ�����ӷ���ʽ��____��
���𰸡�SO2+NO2 +H2O=2H++SO42-+NO n+0.2 ������ɫ���� 2Fe3++HSO3-+H2O=2Fe2++SO42-+3H+
��������
��������AΪ�ؿ��к����ڶ��Ľ�����ȷ��ΪFe��BΪ��ɫ����ȷ��ΪCu������ DΪ����ɫ���壬ȷ��DΪNO2��CΪNO��XΪHNO3��BΪCu��ͭ������Ũ���ᷴӦ��������ͭ�����������ˮ�����ɵĶ��������л�ԭ�ԣ�������NO2��Ӧ������������ᣬȷ��BΪCu��YΪ���ᣬFΪSO2��GΪCuSO4����3��A��Fe����Y�����ᣩ��ϡ��Һ��Ӧ��������������������ȷ��WΪFeSO4��2FeSO4![]() Fe2O3+SO2��+SO3��������MΪSO2��SO3�Ļ���M��NaOH��Ӧ�����κ�ˮ��NΪFe2O3����ϡ���ᷴӦ������������ˮ��Fe3+���������Ժ�+4����Ԫ�ؾ��л�ԭ�ԣ����Է���������ԭ��Ӧ���������������ݴ˷�����
Fe2O3+SO2��+SO3��������MΪSO2��SO3�Ļ���M��NaOH��Ӧ�����κ�ˮ��NΪFe2O3����ϡ���ᷴӦ������������ˮ��Fe3+���������Ժ�+4����Ԫ�ؾ��л�ԭ�ԣ����Է���������ԭ��Ӧ���������������ݴ˷�����
��1���������Ϸ�����֪����Ӧ��ΪSO2��NO2��ˮ�ķ�Ӧ�����ݵ�ʧ��������Ⱥ�ԭ���غ���ƽ�������ӷ�Ӧ����ʽΪSO2+NO2 +H2O=2H++SO42-+NO��
�𰸣�SO2+NO2 +H2O=2H++SO42-+NO
��2��6.4gB�����X��Һ(HNO3)��ַ�Ӧ�����ɵĻ�ԭ������NO2��NO����Ӧ����Һ������HNO3Ϊn mol ����Һ������N![]() �����ʵ���Ϊ��n��N
�����ʵ���Ϊ��n��N![]() ��=n��Cu2+����2+n=
��=n��Cu2+����2+n=![]() +n= n+0.2mol��
+n= n+0.2mol��
�𰸣�n+0.2
��3���ٽ��ͣ�SO2��SO3��ͨ��BaCl2��Һ��������ӦSO3+H2O+BaCl2=BaSO4��+2HCl���а�ɫ�������ɣ�
�𰸣�������ɫ����
�ڷ�Ӧ��2FeSO4![]() Fe2O3+ SO2��+ SO3������Ӧ��Fe2O3+3H2SO4=Fe2(SO4)3+3H2O��
Fe2O3+ SO2��+ SO3������Ӧ��Fe2O3+3H2SO4=Fe2(SO4)3+3H2O��
���ݹ���M��Fe2O3�����������SO2��SO3�����ʵ�����
2FeSO4![]() Fe2O3+ SO2��+ SO3��
Fe2O3+ SO2��+ SO3��
160g 1mol 1mol
1.6g 0.01mol 0.01mol
��Ӧ�� SO3 + 2NaOH=Na2SO4+H2O
1mol 2mol 1mol
0.01mol 0.02mol 0.01mol
SO2+ NaOH = NaHSO3
1mol 1mol 1mol
0.01mol 0.01mol 0.01mol
��Һ1ΪNa2SO4��NaHSO3�Ļ���
��Ӧ�������������������ԣ����������ƾ��л�ԭ�ԣ����ݵ�ʧ��������Ⱥ�ԭ���غ�ó����ӷ���ʽ2Fe3++HSO3-+H2O=2Fe2++SO42-+3H+��
�𰸣�2Fe3++HSO3-+H2O=2Fe2++SO42-+3H+

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����ҵ�ϣ��ɲ��û�ԭ������β����NO����ԭ��:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ��H<0���ڻ�ѧ�ϣ�����Ӧ���ʷ���ʽ��ʾΪv������=k��������cm(NO����cn��H2�����淴Ӧ���ʷ���ʽ��ʾΪv���棩=k���棩��cx��N2����cy��H2O�������У�k��ʾ��Ӧ���ʳ�����ֻ���¶��йأ�m��n��x��y�з�Ӧ��������ʵ��ⶨ���ں����ܱ������г���NO��H2����T���½���ʵ�飬����й��������£�
N2(g)+2H2O(g) ��H<0���ڻ�ѧ�ϣ�����Ӧ���ʷ���ʽ��ʾΪv������=k��������cm(NO����cn��H2�����淴Ӧ���ʷ���ʽ��ʾΪv���棩=k���棩��cx��N2����cy��H2O�������У�k��ʾ��Ӧ���ʳ�����ֻ���¶��йأ�m��n��x��y�з�Ӧ��������ʵ��ⶨ���ں����ܱ������г���NO��H2����T���½���ʵ�飬����й��������£�
ʵ�� | c(NO)/mol��L-1 | c(H2)/mol��L-1 | v(��)/mol��L-1��min-1 |
�� | 0.10 | 0.10 | 0.414k |
�� | 0.10 | 0.40 | 1.656k |
�� | 0.20 | 0.10 | 1.656k |
�����й��ƶ���ȷ����
A. ������Ӧ�У���Ӧ��������������������������
B. �������¶ȣ���k����������k���棩��С
C. ��������Ӧ�У���Ӧ������m=2��n=1
D. ��һ���¶��£�NO��H2��Ũ�ȶ�����Ӧ����Ӱ��̶���ͬ
����Ŀ��C��N��S�������ﳣ�����һЩ�������⣬���й����������о��ø��ֻ�ѧ������������Щ���ʶԻ����IJ���Ӱ�졣
��1���ڴ������ڵ������£���H2��NO��ԭΪN2����֪��

��������һ��������Ӧ���ɵ�����ˮ�������Ȼ�ѧ����ʽ��_____��
��2����500���ºϳɼ״��ķ�Ӧԭ��Ϊ��
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)��1L���ܱ������У�����1mol CO2��3mol H2��ѹǿΪp0�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��(���淴Ӧ��ƽ�ⳣ��������ƽ��Ũ�ȼ��㣬Ҳ������ƽ���ѹKp����ƽ��Ũ�ȣ������ѹ����ѹ�����ʵ�������)
CH3OH(g)��H2O(g)��1L���ܱ������У�����1mol CO2��3mol H2��ѹǿΪp0�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��(���淴Ӧ��ƽ�ⳣ��������ƽ��Ũ�ȼ��㣬Ҳ������ƽ���ѹKp����ƽ��Ũ�ȣ������ѹ����ѹ�����ʵ�������)
�ٷ�Ӧ���е�4minʱ��v(��)__v(��) (����>����<����������)��0��4min��H2��ƽ����Ӧ����v(H2)��_mol��L��1��min��1��

��CO2ƽ��ʱ���������Ϊ___�����¶���KpΪ__(�ú���p0��ʽ�ӱ�ʾ)��
��������˵���÷�Ӧ�Ѵﵽƽ��״̬����___��
A.v��(CH3OH)��3v��(H2)
B.CO2��H2��CH3OH��H2OŨ��֮��Ϊ1��3��1��1
C.���º�ѹ�£������������ٱ仯
D.���º����£�������ܶȲ��ٱ仯
��500�桢��2���ݻ�����2L���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
���� | ������ | ������ |
��Ӧ����ʼͶ���� | 1mol CO2��3mol H2 | 0.5mol CO2��1mol H2 1mol CH3OH��1mol H2O |
CH3OH��ƽ��Ũ��/mol ��L��1 | C1 | C2 |
���������з�Ӧ��ʼ��___������У�c1___c2��(����>����<����������)
��3���״���Ϊһ��ȼ�ϻ�������ȼ�ϵ�ء����¶�Ϊ650���������ȼ�ϵ�����ü״���������CO2�Ļ����������Ӧ������缫����Li2CO3��Na2CO3�����������ʡ��õ�صĸ�����ӦʽΪ___��