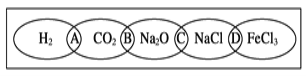
��Ŀ����
����Ŀ����ʵ�������ö������̸�Ũ���ᷴӦ�Ʊ����﴿�������������д�ʵ�飬����������ͼ��
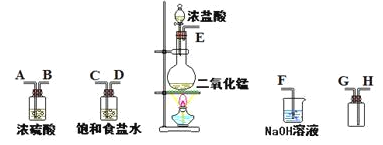
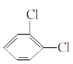
��1������������������ȷ˳���ǣ�����ӿڴ�����ĸ����E�� �� �� �� �� �� �� ��___
��2����װ���б���ʳ��ˮ���������___��
��3����ѧʵ���м����Ƿ���Cl2����������ֽΪ___��
��4��д������������Һ�з�Ӧ�����ӷ���ʽ___��
��5����0.2molMnO2��500mL12mol/L�����Ϻ����ȣ�MnO2��Ӧ��ȫ�������µ���Һ�м�������AgNO3��Һ������AgCl���������ʵ���Ϊ___������������Ļӷ����������ܽ⣩��
��6��ʵ����Ҳ������K2Cr2O7�����ᷴӦ��ȡCl2����ƽ��Ӧ����ʽ����ָ���������ͻ�ԭ�������ʵ���֮����___��________K2Cr2O7+________HCl=________KCl+________CrCl3+________Cl2��+________H2O
��7����֪��ԭ�ԣ�SO32->I-����amolKI��amolK2SO3�Ļ��Һ��ͨ��bmolCl2��ַ�Ӧ(������Cl2��I2֮��ķ�Ӧ)������˵������ȷ����___
A����a��bʱ�����������ӷ�ӦΪSO32-+Cl2+H2O=SO42-+2H++2Cl-
B����5a=4bʱ�����������ӷ�ӦΪ4SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl-
C����a<b<![]() ʱ����Һ��SO42-��I-��Cl-�����ʵ���֮��Ϊa��(3a-2b)��2b
ʱ����Һ��SO42-��I-��Cl-�����ʵ���֮��Ϊa��(3a-2b)��2b
D����a��b��![]() ʱ����Ӧ��ת�Ƶ��ӵ����ʵ���n(e-)Ϊamol��n(e-)��3amol
ʱ����Ӧ��ת�Ƶ��ӵ����ʵ���n(e-)Ϊamol��n(e-)��3amol
���𰸡�CDABHGF ��ȥ�����е��Ȼ������� ʪ��ĵ�����KI��ֽ Cl2+2OH-=Cl-+ClO-+H2O 5.6mol 1��6 1 14 2 2 3 7 D
��������
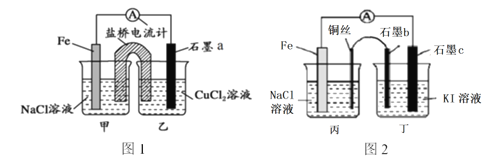
��1������ʵ�����Ʊ�����װ�õ�һ������˳����װ��������װ�����ռ�װ����β������װ�ý��
��2�������������Ȼ�������ʷ�����
��3�����������������Է�����
��4������������Һ��������Ӧ�����Ȼ��ơ��������ƺ�ˮ��
��5�����ݷ�ӦMnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O���������������������ټ��㷴Ӧ��ȫ��������ӣ��ټ�������AgCl�������ʵ�����
MnCl2+Cl2��+2H2O���������������������ټ��㷴Ӧ��ȫ��������ӣ��ټ�������AgCl�������ʵ�����
(6)��Ӧ��K2Cr2O7��CrCl3, CrԪ�ػ��ϼ���+6����Ϊ+3��������6�ۣ�Cl-(Ũ)��Cl2, ClԪ�ػ��ϼ���-1������Ϊ0�۹�����Ϊ2�ۣ��ٸ���ԭ���غ���ƽ�������ʵ�ϵ������ƽ��ķ���ʽ��
(7)��ȷ������ԭ��Ӧ�еķ�Ӧ�Ⱥ�˳��������йص����ӷ���ʽ����д��ʽ�ǽ���ؼ�����ȷ������ԭ��Ӧ�еķ�Ӧ�Ⱥ�˳��������йص����ӷ���ʽ����д��ʽ�ǽ���ؼ�����ԭ�ԣ�SO32-��I-������amolKI��amolK2SO3�Ļ��Һ��ͨ��bmolCl2��ַ�Ӧ���������Ⱥ�SO32-��Ӧ����SO32-��Ӧ��ȫ�������ٺ�I-��Ӧ����amolK2SO3��ȫ��Ӧʱ������amol������amolKI��ȫ��Ӧʱ������a/2mol����������amolKI��amolK2SO3��ȫ��Ӧʱ��������1.5amol������
��1��ʵ��װ�õ�����˳��Ϊ������װ��������װ�����ռ�װ����β������װ�ã���Ϊ�ռ��������壬���Գ���װ���г����ܽ������̵��ܳ�������Ϊ����ʳ��ˮ����ˮ��Ũ��������ˮ�ԣ����������ӱ���ʳ��ˮװ�ú�����Ũ����װ�ã��ռ�װ���У���Ϊ������Ũ�ȴ��ڿ����ģ����Գ����ܽ����̵��ܳ�����
�ʴ�Ϊ��E��C��D��A��B��H��G��F��
��2�������л����Ȼ������ʣ��Ȼ��������ڱ���ʳ��ˮ�У������������ܣ������ñ���ʳ��ˮ��ȥ�����е��Ȼ������壻
��3����ѧʵ���м����Ƿ���Cl2����������ֽΪʪ��ĵ�����KI��ֽ������ֽ������������Ļ���ɫ����ΪCl2��
��4��β������ʱ����������Һ��������Ӧ�����Ȼ��ơ��������ƺ�ˮ����Ӧ�����ӷ���ʽΪCl2+2OH-=Cl-+ClO-+H2O��
��5����Ӧ�Ļ�ѧ����ʽΪMnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��n��MnO2��=0.2mol��n��HCl��=0.5L��12mol/L=6mol�����ݷ���ʽ��֪0.2molMnO2��Ӧ��ҪHClΪ0.2mol��4=0.8mol<6mol����MnO2�ɷ�Ӧ��ȫ����MnO2��ȫ��Ӧ������������Ϊ0.2mol��2=0.4mol����Һʣ��Cl-Ϊ6mol-0.2mol��2=5.6mol�����ԣ���Ӧ��ȫ�������µ���Һ�м�������AgNO3��Һ������AgCl�������ʵ�������5.6mol��
MnCl2+Cl2��+2H2O��n��MnO2��=0.2mol��n��HCl��=0.5L��12mol/L=6mol�����ݷ���ʽ��֪0.2molMnO2��Ӧ��ҪHClΪ0.2mol��4=0.8mol<6mol����MnO2�ɷ�Ӧ��ȫ����MnO2��ȫ��Ӧ������������Ϊ0.2mol��2=0.4mol����Һʣ��Cl-Ϊ6mol-0.2mol��2=5.6mol�����ԣ���Ӧ��ȫ�������µ���Һ�м�������AgNO3��Һ������AgCl�������ʵ�������5.6mol��
(6)��Ӧ��K2Cr2O7��CrCl3, CrԪ�ػ��ϼ���+6����Ϊ+3��������6�ۣ�Cl-(Ũ)��Cl2, ClԪ�ػ��ϼ���-1������Ϊ0�۹�����Ϊ2�ۣ����ϼ�������С������Ϊ6����K2Cr2O7��ϵ��Ϊ1��Cl2 ��ϵ��Ϊ3���ٸ���ԭ���غ���ƽ�������ʵ�ϵ������ƽ��ķ���ʽΪK2Cr2O7+ 14HCl(Ũ) ![]() 2KCl+ 2CrCl3 +3Cl2��+7H2O��������K2Cr2O7�ͻ�ԭ��HCl�����ʵ���֮����1��6��
2KCl+ 2CrCl3 +3Cl2��+7H2O��������K2Cr2O7�ͻ�ԭ��HCl�����ʵ���֮����1��6��
(7) A����a��bʱ������ǡ���ܰ�SO32������Ϊ���������������ԭΪ�����ӣ������ӷ���ʽΪSO32-+Cl2+H2O=SO42-+2H++2Cl-��ѡ��A��ȷ��
B����5a=4b��a=0.8bʱ��0.8bmolSO32������0.8bmol������������Ϊ0.8bmolSO42-��0.2bmol����������0.4bmolI-ΪI2�������ӷ���ʽΪ��4SO32����2I����5Cl2��4H2O��4SO42����I2��8H����10Cl����ѡ��B��ȷ��
C����a��b��1.5aʱ��SO32-ȫ��������Ϊ���������I-����ȫ��������������Һ������������ʵ���Ϊamol�����ĵ�����Ϊamol����ʣ�������Ϊ��b-a��mol�����������ĵ����ӵ����ʵ���Ϊ2��b-a��mol������Һ�еĵ����ӵ����ʵ���Ϊamol-2��b-a��mol=��3a-b��mol������������ȫ��Ӧ������Һ�е������ӵ����ʵ���Ϊ2bmol�������Һ��SO42����I����Cl�������ʵ���֮��Ϊa����3a-2b����2b��ѡ��C��ȷ��
D����a��b��1.5aʱ����Ӧ��ת�Ƶ��ӵ����ʵ���n(e-)Ϊ 2amol��n(e-)��3amol��ѡ��D����ȷ��
��ѡD��

 �·Ƿ��̸����100��ϵ�д�
�·Ƿ��̸����100��ϵ�д�����Ŀ��һ�������£������ƺ�CO2���Ƶý��ʯ��4Na+3CO2![]() 2Na2CO3+C(s�����ʯ)
2Na2CO3+C(s�����ʯ)
���������գ�
��1��������Ӧ���漰��Ԫ�ص�ԭ�Ӱ뾶�Ӵ�С��˳��Ϊ____��
��2����֤��̼Ԫ������Ԫ�طǽ���ǿ������ʵ��___��ѡ���ţ���
a.���������ˮ��������� b.����Ԫ�ص���̬�⻯��ķе�
c.CO2��Ԫ�صĻ��ϼ� d.�����⻯�����ȷֽ���¶�
��3����ѹ�£���ѧ�ҳɹ��ؽ�CO2ת��Ϊ��������SiO2�ṹ��ԭ�Ӿ��壬�Ƚ�SiO2��CO2������ԭ�Ӿ�����۷е�ߵͣ���˵�����ɣ�___��
��ѹ | �۵㣨�棩 | �е㣨�棩 |
�� | 97.8 | 882.9 |
Na2CO3 | 851 | 1850�ֽ� |
���ʯ | 3550 | �� |
ʯī | 3850 | 4250 |
��4������2L�ܱ������У�10min�ڽ����Ƽ�����0.2mol����CO2��ƽ����Ӧ����Ϊ___���÷�Ӧ�ڳ�ѹ1000���½��У������ұ����ݣ��÷�Ӧ��ƽ�ⳣ������ʽK=___��
��5������2L�ܱ������У���ѹ��1000���£���ʼʱ��������������˵���÷�Ӧ�Ѵﵽƽ��״̬����____��
a.�����ƽ��Ħ���������� b.3v����(Na)=4v����(CO2)
c.������ܶȲ��� d.![]() �ı�ֵ����
�ı�ֵ����