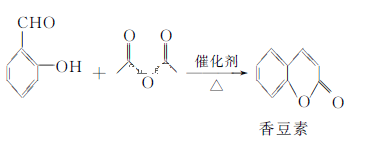
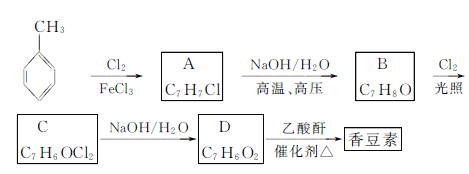
题目内容
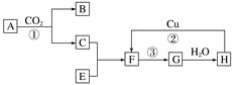
【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

已知:①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3![]() 2NaAlO2+CO;
2NaAlO2+CO;
完成下列填空:
(1)操作Ⅰ在常温下该反应速率极慢,下列措施中能使反应速率增大的是____。
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
(2)固体X中主要含有___(填写化学式)。
(3)操作Ⅳ中有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、___、____、洗涤、干燥。
(4)如表是相关物质的溶解度数据,操作Ⅳ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,该反应在溶液中能发生的理由是____(文字说明)。
物质 | 溶解度(g/100g水) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取![]() 样品,加入过量____(填写试剂)、溶解、过滤、再加入(或通入)____(填写试剂)、……灼烧、冷却、称量,得干燥固体
样品,加入过量____(填写试剂)、溶解、过滤、再加入(或通入)____(填写试剂)、……灼烧、冷却、称量,得干燥固体![]() 。计算样品中氢氧化铝的质量分数为___(用含m、n的代数式表示)。
。计算样品中氢氧化铝的质量分数为___(用含m、n的代数式表示)。
【答案】AC Fe2O3、MgO 冷却结晶 过滤 K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小) NaOH溶液 过量二氧化碳 ![]()
【解析】
铬铁矿的主要成分可表示为FeOCr2O3,还含有MgO、Al2O3、Fe2O3等杂质,因此加入氧气和碳酸钠发生反应①和②,氧化铁、氧化铝不溶于水,操作Ⅰ是过滤,因此得到固体X为Fe2O3、MgO,酸化步骤用酸调节溶液pH<5,依据流程图中物质的转化和制备目的可知所以目的是使CrO42-转化为Cr2O72-,之后根据物质的溶解度大小,从溶液蒸发浓缩、冷却结晶、过滤,将得到的晶体洗涤干燥即可得到晶体。根据此分析进行解答。
(1)增大反应速率可以升高温度或将原料进行粉碎,增大反映的接触面积。
故答案选A C
(2)由反应可知氧化铁、氧化铝不溶于水,操作Ⅰ是过滤,因此得到固体X为Fe2O3、MgO。
故答案为Fe2O3 MgO
(3)利用溶解度得到晶体的一般步骤为:蒸发浓缩、冷却结晶、过滤,将得到的晶体洗涤干燥即可得到晶体。
故答案为 冷却结晶 过滤
(4)由表格数据可看出K2Cr2O7的溶解度很低,是四个物质中最低的,利用溶解度小可以获得K2Cr2O7的晶体。
故答案为 K2Cr2O7的溶解度比K2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小)
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,利用氢氧化铝的两性,加入过量NaOH溶液后过滤,得到四羟基合铝酸钠溶液,再加入CO2,灼烧、冷却得到Al2O3固体,根据铝元素守恒可得氢氧化铝的质量分数=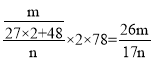 。
。
故答案为![]()

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案