题目内容
【题目】SO2、Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途。完成下列填空:
(1)硫原子核外电子排布式____,钠离子的核外有___种能量不同的电子。
(2)SO2分子构型为“V型”,则SO2是___(选填“极性”、“非极性”)分子,其在水中的溶解度比氯气___(选填“大”、“小”、“一样”)。
(3)棉织物用氯气漂白后,加入Na2S2O3除去余氯时,发生如下反应:___S2O32-+___Cl2+___H2O→___SO42-+___Cl-+___H+
配平该反应方程式,若反应中生成2molSO42-,则转移电子____mol。
(4)Na2S又称臭碱、硫化碱,用离子方程式说明Na2S溶液呈碱性的原因___。
(5)如图是Na2SO3溶液中各离子浓度的相对大小关系示意图。其中,②是___(填微粒符号)。在Na2SO3溶液中各微粒浓度等式关系正确的是____。
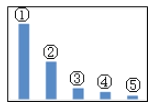
a.c(Na+)=c(SO32-)+2c(HSO3-)+2c(H2SO3)
b.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
c.c(OH-)=c(HSO3-)+c(H+)+c(H2SO3)
【答案】1s22s22p63s23p4 5 极性 大 1 4 5 2 8 10 8 S2-+H2O![]() OH-+HS-,HS-+H2O
OH-+HS-,HS-+H2O![]() OH-+H2S SO32- b
OH-+H2S SO32- b
【解析】
由题可得①反应中S2O32-中的硫由+2价升高到硫酸根离子中的+6价,氯气中的氯元素由0价降低到-1价的氯离子,依据氧化还原反应得失电子守恒结合原子个数守恒规律配平方程式;依据S2O32-~2SO42-~8e-计算转移电子数目;②依据亚硫酸钠为强电解质,完全电离,亚硫酸根离子为多元弱酸根离子,部分发生水解生成亚硫酸氢根离子和氢氧根离子,亚硫酸氢根离子继续水解生成硫离子和氢氧根离子结合水的电离,排序。根据此分析进行解答。
(1)S是第16号元素,其核外电子排布式为:1s22s22p63s23p4,其核外有5种能量不同的电子,故答案为:1s22s22p63s23p4;5;
(2)由于S=O共价键中O原子的吸电子能力比S强,电子对会偏向O原子一侧,导致分子中正负电荷重心不重合,故SO2为极性分子。二氧化硫是个极性分子,Cl2是非极性的,溶剂水是极性的,因此SO2溶解性更好,故答案为:极性;大;
(3)反应中S2O32-中的硫由+2价升高到硫酸根离子中的+6价,氯气中的氯元素由0价降低到-1价的氯离子,依据氧化还原反应得失电子守恒,S2O32-系数为1,Cl2系数为4,依据原子个数守恒,反应方程式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+。若反应中生成2molSO42-,依据S2O32-~2SO42-~8e-,可知转移电子数目为8mol,故答案为1;4;5;2;8;10;8;
(4)Na2S溶液显碱性,其主要原因是硫离子在溶液中水解,电离方程式为:S2-+H2O![]() OH-+HS-,故答案为:S2-+H2O
OH-+HS-,故答案为:S2-+H2O![]() OH-+HS-,HS-+H2O
OH-+HS-,HS-+H2O![]() OH-+H2S
OH-+H2S
(5)由于呈碱性,所以Na2SO3溶液中各离子浓度的相对大小为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),故②为SO32-,根据电荷守恒得c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)。
故答案为:SO32-;b。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸60.0mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
实验序号 | I | II | III | IV |
盐酸体积(mL) | 60.0 | 60.0 | 60.0 | 60.0 |
样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
CO2体积(mL) | 672 | 840 | 896 | 672 |
(1)样品中物质的量之比n(NaHCO3):n(Na2CO3)=___。
(2)盐酸的物质的量浓度c(HCl)=___。
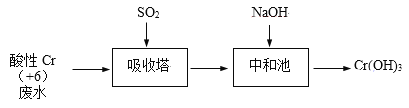
【题目】含+6价铬的废水毒性强,对环境污染严重。化工厂常用SO2处理含铬废水,其工艺流程如下图所示:
已知:Cr2O72- + H2O ![]() 2CrO42- + 2H+
2CrO42- + 2H+
(1)将吸收塔中1mol Cr2O72-与SO2反应的热化学方程式补全。
Cr2O72-(aq) + __SO2(g) + ___ ___ + ___ +___ ΔH = -1145 kJ/mol
(2)其他条件不变,研究吸收塔中pH对反应的影响。
pH | 2 | 4 | 6 |
Cr(+6) 最大去除率 | 99.99% 达排放标准 | 99.95% 达排放标准 | 99.5% 未达排放标准 |
时间 | 30 min | 35 min | 45 min |
①由上述数据获得的结论有________。
②实际工业生产控制pH = 4左右的原因是________。
③下列说法不合理的是________。
a.该酸性含铬废水中一定含有CrO42-,pH越大其含量越高
b.其他条件不变,增大压强,吸收塔中反应的K增大,有利于除去Cr(+6)
c.理论上看,SO32-、Fe2+等也可以用于除去Cr(+6)
(3)其他条件不变,研究温度对Cr(+6)去除率的影响(如图1所示)。
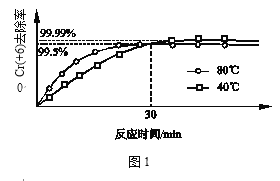
30min前相同时间内,80℃的Cr(+6)去除率比40℃高,30min后80℃的Cr(+6)去除率低,原因分别是_______;_______。
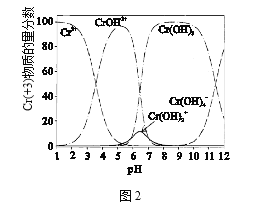
(4)图2为Cr(+3)微粒物质的量分数随溶液pH的变化关系示意图,中和池中应控制pH范围为_________。
(5)废水中Cr(+6)总浓度为a×10-3 mol/L,处理1000 L废水,去除率要求达到99.95%,理论上需要SO2物质的量为_________mol(写计算式)。
