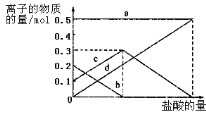
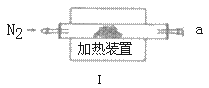
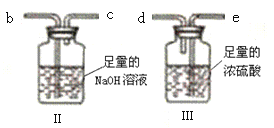
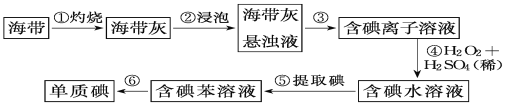
0 196529 196537 196543 196547 196553 196555 196559 196565 196567 196573 196579 196583 196585 196589 196595 196597 196603 196607 196609 196613 196615 196619 196621 196623 196624 196625 196627 196628 196629 196631 196633 196637 196639 196643 196645 196649 196655 196657 196663 196667 196669 196673 196679 196685 196687 196693 196697 196699 196705 196709 196715 196723 203614