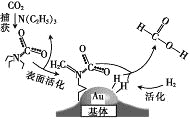
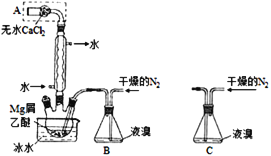
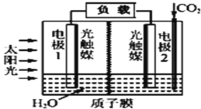
题目内容
【题目】在100g浓度为ω%的稀硫酸中加入4g氧化铜粉末,待氧化铜全部溶解后,向所得蓝色溶液中加入10g铁粉,充分反应后,过滤,得滤液和4.8g滤渣.下列计算结果正确的是
A.4.8g滤渣是由3.2g铜和1.6g铁组成B.ω=14.7
C.反应过程中产生的氢气是2.24LD.滤液是20.88%的硫酸亚铁溶液
【答案】AB
【解析】
所得滤渣中铜元素的质量与氧化铜中铜元素的质量相等,则铜的质量为:4g![]() =32g,故滤渣中铁的质量为4.8g-3.2g=1.6g,设生成3.2g铜需要铁的质量为x,
=32g,故滤渣中铁的质量为4.8g-3.2g=1.6g,设生成3.2g铜需要铁的质量为x,
Fe+CuSO4=FeSO4+Cu
56 64
x 3.2g
![]() ,解得x=2.8g,而剩余的滤渣中含铁的质量是1.6g,故与硫酸反应的铁的质量为:10g-2.8g-1.6g=5.6g,设生成的氢气的质量为z,
,解得x=2.8g,而剩余的滤渣中含铁的质量是1.6g,故与硫酸反应的铁的质量为:10g-2.8g-1.6g=5.6g,设生成的氢气的质量为z,
Fe+H2SO4=FeSO4+H2↑
56 2
5.6g z
![]() =
=![]() ,解得z=0.2g,反应中硫酸全部转化生成硫酸亚铁,根据铁、硫酸和硫酸亚铁的质量关系,设消耗的硫酸的质量为a,生成的硫酸亚铁的质量为b
,解得z=0.2g,反应中硫酸全部转化生成硫酸亚铁,根据铁、硫酸和硫酸亚铁的质量关系,设消耗的硫酸的质量为a,生成的硫酸亚铁的质量为b
Fe~ H2SO4~ FeSO4
56 98 152
8.4g a b
![]() =
=![]() =
=![]() ,解得a=14.7 b=22.8g 。
,解得a=14.7 b=22.8g 。
A、根据计算可知4.8g的滤渣是由3.2g铜和1.6g铁组成,故A正确;
B、硫酸溶液的质量分数为:![]() 1=14.7
1=14.7![]() ,故B正确;
,故B正确;
C、状况不知,无法求气体体积,故C错误;
D.硫酸亚铁溶液的质量分数为:![]() /
/![]() =20.9
=20.9![]() ,故D错误;
,故D错误;
答案为AB。

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目