题目内容
【题目】羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H=-34kJ/mol
H2S(g)+CO2(g) △H=-34kJ/mol
氢解反应:COS(g)+H2(g) ![]() H2S(g)+CO(g) △H=+7kJ/mol。
H2S(g)+CO(g) △H=+7kJ/mol。
已知:2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol。
写出表示CO燃烧热的热化学方程式:______________。
(2)氢解反应达到平衡后,保持体系的温度和总压强不变,通入适量的He,正反应速率____(填“增大”“减小”或“不变”,下同),COS的转化率_______。
(3)某温度下,向体积为2L的恒容密闭容器中通入2molCOS(g)和4molH2O(g),发生水解反应,5min后反应达到平衡,测得COS(g)的转化率为75%。
回答下列问题:
①反应从起始至5min内,v(H2S)=_______mol·L-1·min-1。
②该温度下,上述水解反应的平衡常数K=____________。
【答案】 CO(g)+1/2O2(g)=CO2(g) △H=-283 kJ·mol-l 减小 不变 0.15 1.8
【解析】试题分析:本题考查盖斯定律和燃烧热表示的热化学方程式的书写,外界条件对化学反应速率和化学平衡的影响,化学反应速率和化学平衡常数的计算。
(1)将3个反应依次编号:
COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H=-34kJ/mol(①式)
H2S(g)+CO2(g) △H=-34kJ/mol(①式)
COS(g)+H2(g) ![]() H2S(g)+CO(g) △H=+7kJ/mol(②式)
H2S(g)+CO(g) △H=+7kJ/mol(②式)
2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol(③式)
应用盖斯定律,将①式-②式+③式![]() 得,CO(g)+
得,CO(g)+![]() O2(g)=CO2(g)ΔH=(-34kJ/mol)-(+7kJ/mol)+(-484kJ/mol)
O2(g)=CO2(g)ΔH=(-34kJ/mol)-(+7kJ/mol)+(-484kJ/mol)![]() =-283kJ/mol,则CO燃烧热的热化学方程式为:CO(g)+
=-283kJ/mol,则CO燃烧热的热化学方程式为:CO(g)+![]() O2(g)=CO2(g)ΔH=-283kJ/mol。
O2(g)=CO2(g)ΔH=-283kJ/mol。
(2)保持体系的温度和总压强不变,通入适量的He,容器体积变大,物质的量浓度变小,正反应速率减小,逆反应速率减小。该反应是反应前后气体分子数不变的反应,容器体积变大,即减小压强,平衡不移动,COS的转化率不变。
(3)用三段式,COS(g)+H2O(g)![]() H2S(g)+CO2(g)
H2S(g)+CO2(g)
n(起始)(mol)2 4 0 0
n(转化)(mol)2![]() 0.75=1.5 1.5 1.5 1.5
0.75=1.5 1.5 1.5 1.5
n(平衡)(mol)0.5 2.5 1.5 1.5
①υ(H2S)=![]() =0.15mol/(L·min)。
=0.15mol/(L·min)。
②水解反应的平衡常数K=![]() =
=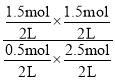 =1.8。
=1.8。

 阅读快车系列答案
阅读快车系列答案