题目内容
【题目】Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:
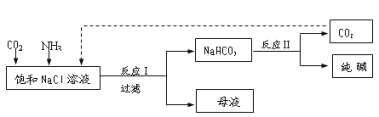
已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为______。
(2)处理母液的两种方法:
①向母液中加入石灰乳,反应的化学方程式为____,目的是使____循环利用。
②向母液中____并降温,可得到NH4Cl晶体。
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。
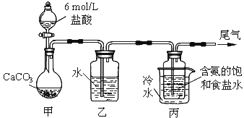
(3)装置丙中冷水的作用是______;由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有______、洗涤、灼烧。
(4)若灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。
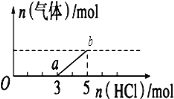
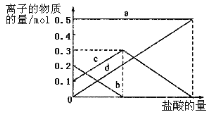
取加热了t1min的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。曲线c对应的溶液中的离子是____(填离子符号);该样品中NaHCO3和Na2CO3的物质的量分别是___mol、___mol。
【答案】NaCl+CO2+NH3+H2O →NaHCO3↓+NH4Cl 2NH4Cl +Ca(OH)2→CaCl2+2NH3↑+2H2O NH3 通入NH3,加入细小的食盐颗粒 冷却,使碳酸氢钠晶体析出 过滤 HCO3- 0.1 0.2
【解析】
(1)由于NaHCO3在低温下溶解度较小,溶液中含有较大浓度的钠离子和碳酸氢根离子时,就会有碳酸氢钠晶体析出,所以饱和氯化钠中溶液中通入NH3和CO2发生反应的方程式为:NaCl+CO2+NH3+H2O →NaHCO3↓+NH4Cl;答案:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
(2)①根据题中反应流程可知,过滤后得到的母液中含有氯化铵,母液中加入石灰乳后,发生反应为:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O,反应生成氨气,氨气可以在反应流程中循环利用;答案:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;NH3;
②由反应NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓及流程图知,母液中溶质为氯化铵,向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入的氨气和水反应生成一水合氨,一水合氨能电离铵根离子,铵根离子浓度增大有利于氯化铵析出。
答案:通入NH3,加入细小的食盐颗粒。
(3)由装置丙中产生的是NaHCO3,其溶解度随温度降低而降低,所以装置丙中冷水的作用是:冷却,使碳酸氢钠晶体析出;制取Na2CO3时需要过滤得到晶体,洗涤后加热灼烧得到碳酸钠;答案:冷却,使碳酸氢钠晶体析出;过滤;
(4)若在(2)中灼烧的时间较短, NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了研究.取加热了t1min的NaHCO3样品29.6g 完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,发生反应CO32-+H+=HCO3-;HCO3-+ H+=CO2![]() +H2O;溶液中有关离子的物质的量的变化为碳酸根离子减小,碳酸氢根离子浓度增大,当碳酸根离子全部转化为碳酸氢根离子,再滴入盐酸和碳酸氢根离子反应生成二氧化碳,碳酸氢根离子减小,所以c曲线表示的是碳酸氢根离子物质的量变化。碳酸根离子物质的量为0.2mol,碳酸氢根离子物质的量为0.1mol;所以样品中NaHCO3的物质的量为0.1mol,Na2CO3的物质的量为0.2mol;
+H2O;溶液中有关离子的物质的量的变化为碳酸根离子减小,碳酸氢根离子浓度增大,当碳酸根离子全部转化为碳酸氢根离子,再滴入盐酸和碳酸氢根离子反应生成二氧化碳,碳酸氢根离子减小,所以c曲线表示的是碳酸氢根离子物质的量变化。碳酸根离子物质的量为0.2mol,碳酸氢根离子物质的量为0.1mol;所以样品中NaHCO3的物质的量为0.1mol,Na2CO3的物质的量为0.2mol;
因此,本题正确答案是: HCO3-;0.1;0.2。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案