题目内容
【题目】某学习小组在实验室制取乙酸乙酯的主要步骤如下:
①配制2mL浓硫酸、3mL乙醇(含18O)和2mL乙酸的混合溶液。
②按如图连接好装置并加入混合液,用小火均匀加热3~5min。
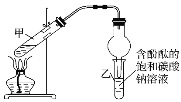
③待试管乙收集到一定量产物后停止加热,撤出试管乙用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
回答问题:
(1)配制混合液的操作顺序是___。
(2)装置中球形干燥管,除起冷凝作用外,另一重要作用是___。
(3)步骤②安装好实验装置,加入药品前还应检查___。
(4)写出实验中加热试管的目的:①___;②___。
(5)反应中浓硫酸的作用是__;写出能表示18O位置的制取乙酸乙酯的化学方程式:___。
(6)上述实验中饱和碳酸钠溶液的作用是__。(填字母)
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(7)步骤③所观察到的现象是___,从试管乙中分离出乙酸乙酯的实验操作名称是___。
【答案】先加入乙醇(含18O),然后边摇动试管边慢慢加入浓硫酸,冷却后,再加乙酸 防止倒吸 装置的气密性 加快反应速率 及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动 催化剂、吸水剂 CH3COOH+C2H518OH![]() CH3CO18OC2H5+H2O BC 试管乙中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅 分液
CH3CO18OC2H5+H2O BC 试管乙中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅 分液
【解析】
浓硫酸的密度比乙酸、乙醇的密度大,稀释浓硫酸时会放出大量的热;乙酸和乙醇易溶于水,容易引起倒吸;酯化反应的实质是酸去羟基醇去氢。
(1)浓硫酸的密度大于乙酸、乙醇的密度,稀释浓硫酸时会放出大量的热,同时为减少乙醇和乙酸的挥发,所以配制混合液的操作顺序是先加入密度小的乙醇(含18O),然后边摇动试管边慢慢加入浓硫酸,冷却后,再加乙酸;
(2)干燥管的作用:一是起冷凝的作用,二是防倒吸的作用,因为乙酸和乙醇易溶于碳酸钠;
(3)因为产生蒸气,因此加药品前,要检验装置的气密性;
(4)加热试管的目的:①加热,温度升高,能加快反应速率;②乙酸乙酯沸点低,加热时能及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动;
(5)反应中浓硫酸的作用是催化剂:加快反应速率、吸水剂:以利于平衡向生成乙酸乙酯的方向移动;酯化反应的实质是酸去羟基醇去氢,化学方程式为CH3COOH+C2H518OH![]() CH3CO18OC2H5+H2O;
CH3CO18OC2H5+H2O;
(6)乙酸乙酯中混有乙酸和乙醇,乙醇易溶于水,乙酸可以和碳酸钠反应,因此碳酸钠的作用是除去乙酸、吸收乙醇、降低乙酸乙酯的溶解度,即选项B C正确;
(7)乙酸乙酯是不溶于水的液体,且密度小于水,现象:试管乙中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;采用分液的方法进行分离。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案