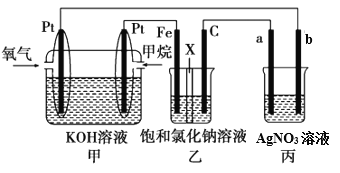
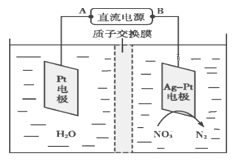
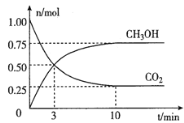
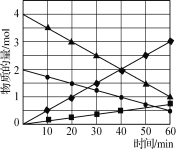
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)今有如下两个热化学方程式:则a _____ b (填“>”、“=”或“<”)
H2(g)+![]() O2(g)═H2O (l) △H1=a kJmol﹣1
O2(g)═H2O (l) △H1=a kJmol﹣1
H2(g)+![]() O2(g)═H2O (g) △H2=b kJmol﹣1
O2(g)═H2O (g) △H2=b kJmol﹣1
(2)拆开lmol气态物质中某种共价键需要吸收的能量叫键能,部分化学键键能如表。
化学键 | H﹣H | N﹣H | N≡N |
键能/kJmol﹣1 | 436 | a | 945 |
已知反应N2(g)+3H2(g)=2NH3(g) △H=-93 kJmol﹣1,试根据表中所列键能数据计算a=______________。
(3)利用水煤气合成二甲醚(CH3OCH3)的三步反应如下:
①2H2(g)+ CO(g)═ CH3OH(g) △H1
②2CH3OH(g)═ CH3OCH3(g)+ H2O(g) △H2
③3 H2(g)+3CO(g)═ CO2(g) + CH3OCH3(g) △H3
反应③为制取二甲醚的第3步反应,利用△H1和△H2计算△H3时,还需要利用________反应的△H。
(4)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如图。

图中CO2转化为CO的反应为: CO2(g)+H2(g) = CO(g)+H2O(g) △H= +41kJ/mol
已知:2CO2(g) + 6H2(g) = C2H4(g) + 4H2O(g) △H= -128kJ/mol
则图中CO转化为C2H4的热化学方程式是______________________________________。
【题目】I、如图所示,高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是______________。

A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O![]()
B.晶体中每个K+周围有8个O![]() ,每个O
,每个O![]() 周围有8个K+
周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧与-2价氧的数目比为3∶1
II、有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这3种晶体进行实验,结果如表所示:
项目 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 |
A | 811 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
B | 3500 | 很大 | 不溶 | 不导电 | 不反应 |
C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体A的化学式为____________________。
(2)晶体B的晶体类型为____________________。
(3)晶体C中粒子间的作用力为____________________。
III、砷化镓是优良的半导体材料,可用于制作微型激光器或太阳能电池等。
(1)砷化镓的晶胞结构如下图所示,则砷化镓的化学式为____。

(2)基态As原子的核外电子排布式为_________。
(3)第一电离能:Ga____As(填“>”或“<”)。
(4)GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是_________。