题目内容
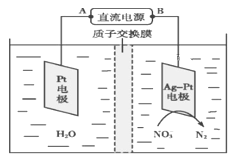
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。

请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是:____________________________________。
(2)乙中X是_________交换膜,向乙中加入几滴酚酞溶液,工作一段时间后铁电极附近溶液变红,请用化学用语解释相关原因______________________________________________
(3)若在标准状况下,有4.48 L氧气参加反应,则乙装置中C电极上生成的气体的物质的量为__________。
(4)欲用丙装置给铜镀银,b应是____________(填化学式)。
(5)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解NO3—的原理如图所示。
①Ag-Pt电极上的电极反应式为___________________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
【答案】CH4-8e-+10OH-= CO32-+7H2O 阳离子 铁为阴极,氢离子放电,剩余氢氧根离子,氢氧根浓度不断增大,使得酚酞溶液变红。 0.4 mol Ag 2NO3-+10e-+12H+= N2↑+6H2O 14.4g
【解析】
⑴甲烷燃料电池,燃料作负极,氧化剂作正极,其负极电极反应式是:CH4-8e-+10OH-= CO32-+7H2O,
故答案为:CH4-8e-+10OH-= CO32-+7H2O;
⑵为了阻止阴极产生的OH-通过离子交换膜进入阳极室,和阳极产生的Cl2反应,乙中X采用的是阳离子交换膜,向乙中加入几滴酚酞溶液,工作一段时间后铁电极附近溶液变红,原因是铁为阴极,氢离子放电,剩余氢氧根离子,氢氧根浓度不断增大,使得酚酞溶液变红。
故答案为:阳离子;铁为阴极,氢离子放电,剩余氢氧根离子,氢氧根浓度不断增大,使得酚酞溶液变红。
⑶若在标准状况下,有4.48 L氧气参加反应,根据电子守恒,氧气和氯气的物质的量之比为1:2,
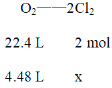
x = 0.4 mol
则乙装置中C电极上生成的气体的物质的量为0.4 mol
故答案为:0.4 mol
⑷电镀时镀件作阴极,镀层金属作阳极,所以丙装置给铜镀银,b是阳极,用Ag,
故答案为:Ag;
⑸Ag-Pt电极上,氮的化合价降低,发生还原反应,其电极反应式为2NO3-+10e-+12H+= N2↑+6H2O,
故答案为:2NO3-+10e-+12H+= N2↑+6H2O;
若电解过程中转移电子为2 mol,
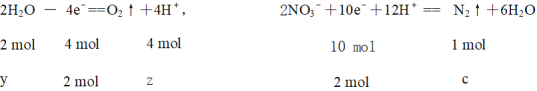
解得y = 1 mol z = 2 mol c = 0.5 mol
左边质量减少即为消耗水的质量18 g,右边质量减少为生成氮气的质量再减去移动过来的氢离子的质量即![]()
Δm左-Δm右 = 18g – 3.6g =14.4g。

 名校课堂系列答案
名校课堂系列答案【题目】I、如图所示,高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是______________。
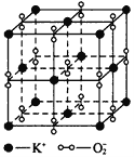
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O![]()
B.晶体中每个K+周围有8个O![]() ,每个O
,每个O![]() 周围有8个K+
周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧与-2价氧的数目比为3∶1
II、有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这3种晶体进行实验,结果如表所示:
项目 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 |
A | 811 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
B | 3500 | 很大 | 不溶 | 不导电 | 不反应 |
C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体A的化学式为____________________。
(2)晶体B的晶体类型为____________________。
(3)晶体C中粒子间的作用力为____________________。
III、砷化镓是优良的半导体材料,可用于制作微型激光器或太阳能电池等。
(1)砷化镓的晶胞结构如下图所示,则砷化镓的化学式为____。

(2)基态As原子的核外电子排布式为_________。
(3)第一电离能:Ga____As(填“>”或“<”)。
(4)GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是_________。
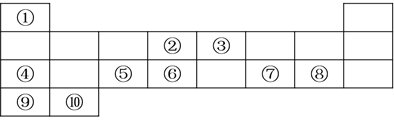
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中________(填元素符号)的非金属性最强;________(填元素符号)的金属性最强,写出该元素的单质与水反应的离子方程式:___________________________________________________。
(2)表中元素③的原子结构示意图是____________。
(3)表中元素⑥、⑦的氢化物的稳定性顺序为
(4)表中元素最高价氧化物对应水化物酸性最强的是________(填化学式)。