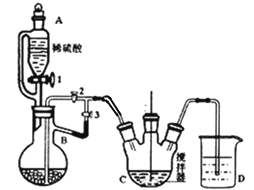
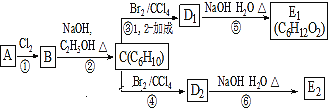
��Ŀ����
����Ŀ�������������ж���������Σ���ܴ���˺�����ˮ������д��������ŷš���֪��Cr3+![]() Cr(OH)3
Cr(OH)3![]() CrO2-��
CrO2-��
(1)�ں�+6�۸��ķ�ˮ�м���һ���������������������ʹ+6�۸���ԭ��+3�۸����ٵ�����ҺpH��6��8֮�䣬ʹFe3+��Cr3+ת��ΪFe(OH)3��Cr(OH)3��������ȥ��
��д��Cr2O72-��FeSO4��Һ�����������·�Ӧ�����ӷ���ʽ_______________________��
�������ӷ���ʽ��ʾ��ҺpH���ܳ���10��ԭ��__________________________________��
����������ķ�ˮ�в�����c(Fe3+)=2��10��13 mol/L���������Cr3+��Ũ��Ϊ___________��(��֪��Ksp[Fe(OH)3]=4.0��10-38 Ksp[Cr(OH)3]=6.0��10-31)
(2)����+6�۸��ķ�ˮ��������ڣ������������������������Ȼ��ƽ��е�⡣���������ɵ�Fe2+��Cr2O72һ������Ӧ�����ɵ�Fe3+��Cr3+����������OHһ��ϳ����������������ȥ��
��д�������ĵ缫��Ӧʽ__________________________��
�ڵ�ⷨ�м����Ȼ��Ƶ�������______________________��
(3)ij��ѧ��ȤС���Ժ�+6�۸���+2���̵Ĺ�ҵ��ˮΪ�������о���м������pH�Է�ˮ�и�����ȥ���ʵ�Ӱ�졣
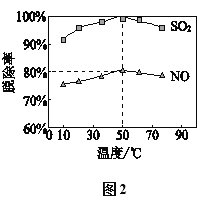
��ȡ100mL��ˮ��250 mL����ƿ�У�����pH���涨ֵ���ֱ���벻ͬ���ķ���м���õ���м�����Ը�����ȥ���ʵ�Ӱ������ͼ��ʾ������pHһ��ʱ����ˮ����м����Ϊ____________ʱ���̡���ȥ������á�
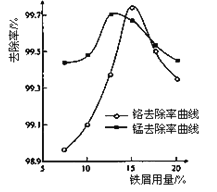
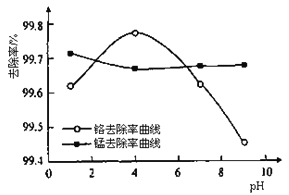
��ȡ100mL��ˮ��250 mL����ƿ�У�����涨�����ۣ����ɲ�ͬ��pH���õ�pH�Ը�����ȥ���ʵ�Ӱ������ͼ��ʾ��������м����һ��ʱ����ˮpH=__________ʱ�̡���ȥ������á�
���𰸡�Cr2O72++6Fe2++14H+=2Cr3++6Fe3++7H2O Cr(OH)3 +OH-=CrO2-+2H2O 3��10-6 mol/L 2H++2e-=H2����2H2O+2e-=H2��+2OH- ��ǿ��Һ������ 15% 4
��������
(1)��Cr2O72-��FeSO4��Һ�����������»ᷢ��������ԭ��Ӧ��
���������֪����pH����10��c(OH-)��10-4mol/Lʱ��Cr(OH)3ת���CrO2-��
(2)��������ˮ�е������ӷŵ�����������
��ˮ��������ʣ��������ܽϲ�Ȼ�����ǿ���������ǿˮ�ĵ����ԣ�
(3)����ͼ��֪�����������ӵ�ȥ���ʶ��ϴ�ʱ����Ӧ��pHֵ�Ͱٷ������Ǵ���ֵ��
(1)��Cr2O72-��FeSO4��Һ�����������»ᷢ��������ԭ��Ӧ������Cr3+��Fe3+��H2O�����ݵ����غ㡢����غ㼰ԭ���غ㣬�ɵ÷�Ӧ�����ӷ���ʽCr2O72++6Fe2++14H+=2Cr3++6Fe3++7H2O��
���������֪����pH����10��c(OH-)��10-4mol/Lʱ��Cr(OH)3ת���CrO2-������Cr(OH)3+OH-=CrO2-+2H2O��
(2)�ٽ���+6�۸��ķ�ˮ��������ڣ������������������������Ȼ��ƽ��е�⣬��������ʧ�������ɶ��������ӣ������������ӵõ��������������缫��ӦʽΪ��2H++2e-=H2����2H2O+2e-=H2��+2OH-��
��ˮ��������ʣ���������ˮ�ĵ���������С���Ȼ�����ǿ����ʣ���ˮ������ȫ���뵼����Һ��������Ũ��������������ǿ��Һ�����ԣ�
(3)�ٸ���ͼ1֪����������������ʱ�����ӵ�ȥ������������С������ˮ����м����Ϊ15%ʱ�̡���ȥ������ã�
�ڸ���ͼ2֪������Һ��pHֵ������ʱ�������ӵ�ȥ�����ȼ�С��������ȥ������������С����pH=4ʱ�̡���ȥ������á�

����Ŀ��Ϊ�˺������û�ѧ�ܣ�ȷ����ȫ���������������Ҫ��ֿ��ǻ�ѧ��Ӧ�ķ�Ӧ�ȣ�����ȡ��Ӧ��ʩ����ѧ��Ӧ�ķ�Ӧ��ͨ����ʵ����вⶨ��Ҳ�ɽ����������㡣
��1���������������Ȼ�ѧ����ʽ����a _____ b ����������������������������
H2��g��+![]() O2��g���TH2O ��l�� ��H1��a kJmol��1
O2��g���TH2O ��l�� ��H1��a kJmol��1
H2��g��+![]() O2��g���TH2O ��g�� ��H2��b kJmol��1
O2��g���TH2O ��g�� ��H2��b kJmol��1
��2����lmol��̬������ij�ֹ��ۼ���Ҫ���յ������м��ܣ����ֻ�ѧ�����������
��ѧ�� | H��H | N��H | N��N |
����/kJmol��1 | 436 | a | 945 |
��֪��ӦN2��g��+3H2��g����2NH3��g�� ��H��-93 kJmol��1���Ը��ݱ������м������ݼ���a=______________��
��3������ˮú���ϳɶ����ѣ�CH3OCH3����������Ӧ���£�
��2H2��g��+ CO��g���T CH3OH��g�� ��H1
��2CH3OH��g���T CH3OCH3��g��+ H2O��g�� ��H2
��3 H2��g��+3CO��g���T CO2��g�� + CH3OCH3��g�� ��H3
��Ӧ��Ϊ��ȡ�����ѵĵ�3����Ӧ��������H1����H2������H3ʱ������Ҫ����________��Ӧ����H��
��4���п�Ժ������ѧ�����о����Ŀ�����Ա���������״���Na-Fe3O4��HMCM-22 �ı��潫CO2ת��Ϊ�������������ͼ��
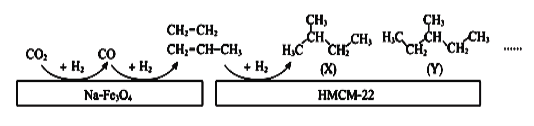
ͼ��CO2ת��ΪCO�ķ�ӦΪ�� CO2(g)+H2(g) = CO(g)+H2O(g) ��H= +41kJ/mol
��֪��2CO2(g) + 6H2(g) = C2H4(g) + 4H2O(g) ��H= -128kJ/mol
��ͼ��COת��ΪC2H4���Ȼ�ѧ����ʽ��______________________________________��