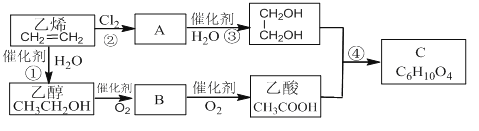
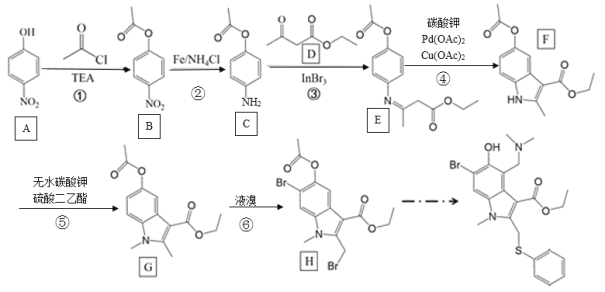
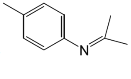
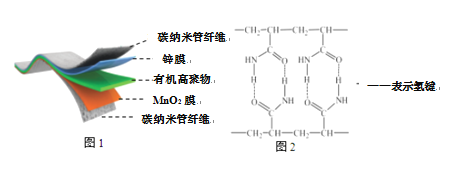
题目内容
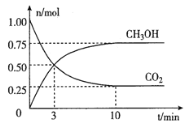
【题目】40 ℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是
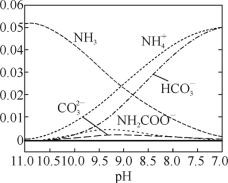
A. 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B. 随着CO2的通入,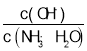 不断增大
不断增大
C. 不同pH的溶液中存在关系:c(NH4+)+c(H+)=c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
D. 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
【答案】BC
【解析】
A.pH=9时,图象中各种离子浓度的大小关系:c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-),A正确;
B.已知Kb=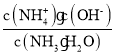 ,温度一定时,Kb为常数,不随浓度的变化而变化,随着CO2的通入,c(NH4+)逐渐增大,则
,温度一定时,Kb为常数,不随浓度的变化而变化,随着CO2的通入,c(NH4+)逐渐增大,则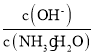 不断减小,B错误;
不断减小,B错误;
C.溶液中存在电荷守恒,即正电荷的总浓度等于负电荷的总浓度,则不同pH的溶液中存在电荷守恒关系为:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-),C错误;
D.由图象可知开始没有NH2COO-,后来也不存在NH2COO-,所以NH2COO-为中间产物,即在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成,D正确。
故合理选项是BC。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目