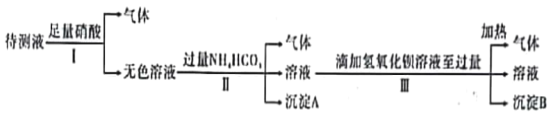
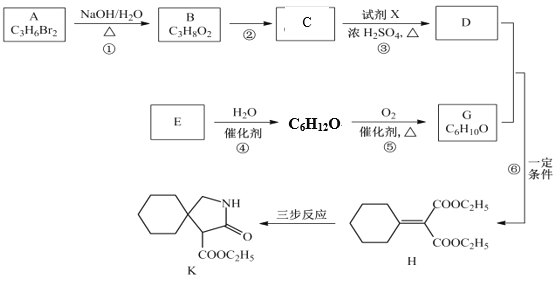
题目内容
【题目】I、如图所示,高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是______________。
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O![]()
B.晶体中每个K+周围有8个O![]() ,每个O
,每个O![]() 周围有8个K+
周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧与-2价氧的数目比为3∶1
II、有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这3种晶体进行实验,结果如表所示:
项目 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 |
A | 811 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
B | 3500 | 很大 | 不溶 | 不导电 | 不反应 |
C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体A的化学式为____________________。
(2)晶体B的晶体类型为____________________。
(3)晶体C中粒子间的作用力为____________________。
III、砷化镓是优良的半导体材料,可用于制作微型激光器或太阳能电池等。
(1)砷化镓的晶胞结构如下图所示,则砷化镓的化学式为____。

(2)基态As原子的核外电子排布式为_________。
(3)第一电离能:Ga____As(填“>”或“<”)。
(4)GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是_________。
【答案】AD NaCl 原子晶体 分子间作用力 GaAs 1s22s22p63s23p63d104s24p3或 [Ar]3d104s24p3 < GaF3为离子晶体,GaCl3为分子晶体
【解析】
I.A.根据平摊法,计算晶胞中K+与O2-个数;
B.由晶胞图可知,晶体中每个K+周围有6个O2-,每个O2-周围有6个K+;
C.由晶胞图可知,晶体中与每个K+距离最近的K+有12个;
D.结合晶胞中K+与O2-个数,根据电荷守恒判断;
II.根据A的水溶液与Ag+反应有白色沉淀,说明A的水溶液中有Cl-,再根据其可以导电得A为NaCl或HCl,又因为其硬度较大,所以判断其为NaCl;由于B的熔点很高、硬度很大、不导电、不溶于水,可判断其应该为原子晶体,所以B为金刚石;C的熔点为负、硬度很小,判断其为气体,易溶于水,水溶液与Ag+反应有白色沉淀,所以C为HCl,结合对应物质的组成和性质判断晶体的类型;
III. (1)由晶胞结构图可知,Ga位于体内,As位于顶点与面心,结合均摊法计算;
(2)As的原子序数为33;
(3)金属性越强,第一电离能越小;
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,熔点不同与晶体类型有关。
I. A.由晶胞图可知,K+的个数为8×![]() +6×
+6×![]() =4,O2-的个数为12×
=4,O2-的个数为12×![]() +1=4,所以物质化学式为KO2,A正确;
+1=4,所以物质化学式为KO2,A正确;
B.由晶胞图可知,晶体中每个K+周围有6个O2-,每个O2-周围有6个K+,故B错误;
C.由晶胞图可知,晶体中与每个K+距离最近的K+有12个,故C错误;
D.晶胞中K+与O2-个数分别为4、4,所以晶胞中共有8个氧原子,根据电荷守恒-2价O原子数目为2,所以0价氧原子数目为8-2=6,所以晶体中,0价氧原子与-2价氧原子的数目比为3:1,D正确;
故合理选项是AD。
II.根据上述分析可知A为NaCl;B为金刚石;C为HCl。
(1)晶体A的化学式为NaCl;
(2)晶体B是金刚石,由于其熔点很高、硬度很大、不导电、不溶于水,故B为原子晶体;
(3)C是HCl,在固体时是由HCl分子构成的分子晶体,HCl分子之间存在分子间作用力;
III.(1)由晶胞结构图可知,Ga位于体内,个数为4,而As位于顶点与面心,个数为8×![]() +6×
+6×![]() =4,则砷化镓的化学式为GaAs;
=4,则砷化镓的化学式为GaAs;
(2)As的原子序数为33,基态As原子的核外电子排布式为[Ar]3d104s24p3;
(3)金属性越强,第一电离能越小,则第一电离能:Ga<As;
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是GaF3为离子晶体,离子间通过离子键结合,而GaCl3为分子晶体,分子之间通过分子间作用力结合,离子键是比分子间作用力强的作用力,因此断裂离子键消耗的能量比分子间作用力大,因此GaF3熔沸点比GaCl3高。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验“操作和现象”与“实验目的、结论”的对应关系中正确的是( )
操作和现象 | 实验目的或结论 | |
A | 将H2S气体通入CuSO4溶液中,产生黑色沉淀 | H2S的酸性比H2SO4的强 |
B | 固体溶解于水后的溶液中加入澄清的石灰水 | 探究家庭“食用碱”的成分是 碳酸钠还是碳酸氢钠 |
C | 某溶液先加稀硝酸,再加BaCl2溶液,产生白色沉淀 | 能证明该溶液中一定含有Ag+ |
D | 向MgCl2溶液(含FeCl3)中加入足量MgCO3粉末 | 除去MgCl2溶液中少量FeCl3 |
A. AB. BC. CD. D
【题目】T℃时,向1.0L恒容密闭容器中充入1.0mol SO3气体,发生反应:2SO3(g)![]() 2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
条件改变 | 结论 | |
A | 平衡后的容器中充入1.0molHe | 平衡逆向移动,化学平衡常数减小 |
B | 起始时向容器中充入1.0molSO2 和0.50molO2 | 达到平衡时共放出78.4kJ的热量 |
C | 起始时向容器中充入2.0 molSO3、0.50 molSO2和0.25 mol O2 | 反应达到平衡前v(正)>v(逆) |
D | 起始向容器中充入2.5 molSO2 和1.25molO2 | 达到平衡时,SO2的转化率为80.0% |
A. AB. BC. CD. D