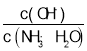题目内容
【题目】CH4、CH3OH、CO等都是重要的能源,也是重要的化工原料。
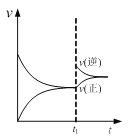
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成CO和液态水时放出38kJ热量,则该条件下反应2CH4(g)+3O2(g) =2CO(g)+4H2O(l)的ΔH=___。
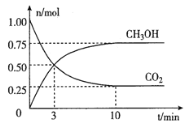
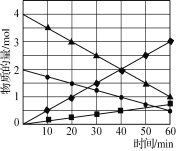
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2L的密闭容器中,充入lmolCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=___。
②达到平衡时,H2的转化率为___。
(3)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)![]() CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和否H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___。
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和否H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1molCH3OH
D.CH3OH的质量分数在混合气体中保持不变
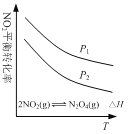
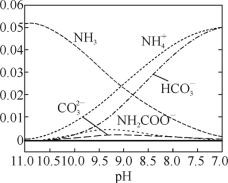
(4)从烟道气中回收硫是有效处理SO2大气污染的有效方法之一,该方法是在催化剂、773K条件下,CO与SO2反应生成CO2和硫蒸气,该反应体系中各组分的物质的量与反应时间的关系如图所示,写出该反应的化学方程式:___。
(5)近几年来关于氮污染的治理倍受关注。向工业废水中加入次氯酸钠溶液,可将其中的NH4+完全转化为N2,而次氯酸钠被还原为NaCl。写出上述反应的离子方程式:___。
【答案】-1216kJ·mol-1 0.0375mol/(L·min) 75% BD 4CO+2SO2 4CO2+S2 2NH4++3ClO-=N2↑+3Cl-+2H++3H2O
4CO2+S2 2NH4++3ClO-=N2↑+3Cl-+2H++3H2O
【解析】
(1)根据![]() 计算出1g甲烷的物质的量,然后可计算出1mol甲烷完全燃烧生成液态水放出的热量,进而计算ΔH;
计算出1g甲烷的物质的量,然后可计算出1mol甲烷完全燃烧生成液态水放出的热量,进而计算ΔH;
(2)①根据速率![]() ,结合三段式进行计算;
,结合三段式进行计算;
(3)化学平衡状态的特征:等,即v正=v逆,定,即达到平衡后反应物、生成物物质的量,质量,浓度,百分含量等保持不变据此判断解答;
(4)结合图像得出反应物和生成物的物质的量的变化量之比,从而写出该反应的化学方程式;
(5)根据题干信息,结合氧化还原反应中得失电子守恒写出反应的离子方程式。
(1)1g CH4的物质的量为:1g÷16g·mol-1=0.0625mol,0.0625molCH4完全燃烧生成液态水放出38kJ热量,则1molCH4完全燃烧生成液态水放出的热量为:38kJ×1mol÷0.06255mol=608kJ,则反应2CH4(g)+3O2(g) =2CO(g)+4H2O(l)的ΔH=-608kJ/mol×2=-1216kJ/mol;
(2)在体积为2L的密闭容器中,充入lmolCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。CO2是反应物随反应进行物质的量减小,CH3OH是生成物,随反应进行物质的量增大;10nim内达到平衡,生成CH3OH物质的量为0.75mol,CO2物质的量变化了0.75mol;则①依据化学平衡列三段式有:
CH3OH(g)+H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。CO2是反应物随反应进行物质的量减小,CH3OH是生成物,随反应进行物质的量增大;10nim内达到平衡,生成CH3OH物质的量为0.75mol,CO2物质的量变化了0.75mol;则①依据化学平衡列三段式有:

①从反应开始到平衡,CO2的平均反应速率![]() ;
;
②达到平衡时,H2的转化率![]() ;
;
(3)A.反应中CO与CH3OH的物质的量之比为1:1,无法确定是否达到平衡状态,不能作为判断平衡的标志,故A错误;
B.该反应前后气体体积不相等,则压强不变说明达到平衡,故B正确;
C.单位时间内每消耗1 mol CO是正速率,同时生成1 mol CH3OH也是正速率,所指的速率都是表示正反应速率,不能作为判断平衡标志,故C错误;
D.CH3OH的质量分数在混合气体中保持不变,CH3OH组成一定,说明达到平衡,故D正确;
故答案为:BD。
(4)根据图像可知,反应物的物质的量的变化量一个为(4-1)mol=3mol,一个为(2-0.5)mol=1.5mol,生成物的物质的量的变化量一个为(3-0)mol=3mol,一个为(0.75-0)mol=0.75mol,则反应物、生成物的物质的量的变化量之比等于其化学计量数之比=3:1.5:3:0.75=4:2:4:1,根据C原子守恒可知,计量数是4的为CO、CO2,二氧化硫的计量数为2,硫单质的计量数为1,则生成的硫单质为S2,所以该反应的化学反应方程式为4CO+2SO2 4CO2+S2;
4CO2+S2;
(5)根据题干信息,次氯酸钠溶液可将废水中的NH4+完全转化为N2,而次氯酸钠被还原为NaCl,结合氧化还原反应得失电子守恒可得反应的离子反应方程式为2NH4++3ClO-=N2↑+3Cl-+2H++3H2O。

【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T12
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
【题目】电解质溶液导电的本质是阴阳离子在电场作用下迁移,通过实验探究同一溶液中不同离子的迁移差异。将pH试纸用不同浓度Na2SO4的溶液充分浸湿,进行如下实验:
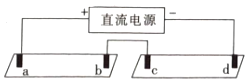
a,b,c,d均是石墨电极,电极间距4cm,电极电流0.20mA。实验现象:
时间 | 试纸Ⅰ | 试纸Ⅱ |
1min | a极试纸附近变红,b极附近试纸变蓝 | c极附近试纸变红,d极附近变蓝 |
10min | 红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm | 两极颜色范围扩大不明显,试纸大部分仍为黄色 |
对实验现象解释及预测不合理的是( )
A.b、d两极附近变蓝的原因:2H2O+2e-=H2↑+2OH-
B.试纸Ⅰ红色区长度大于蓝色区:说明单位时间内OH-的迁移速度快于H+
C.试纸Ⅱ中的现象说明此浓度下迁移的主要离子是Na+和SO42-
D.预测10min后,试纸Ⅰ红蓝区之间又会出现黄色区域