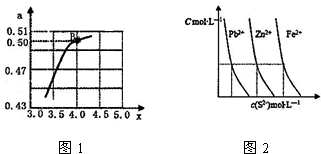
12.下列实验操作正确且能达到实验目的都是( )
| A. | 将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色 | |
| B. | 向盛有20g蔗糖的烧杯中加入几滴水,搅拌均匀:再加入少许浓硫酸,迅速搅拌,探究浓硫酸的吸水性 | |
| C. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| D. | 将表面有铜绿[Cu2(OH)2C03]的铜器放入盐酸中浸泡,除去铜绿 |
11.某化学反应2A(g)?B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)实验1中,在10~20min时间内,以A的速率表示的平均反应速率为0.02mol/(L•min).
(2)实验2中,A的初始浓度c2=1mol•L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是使用催化剂.
(3)测得实验2和实验3各组分百分含量相等.设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3>v1(填“>”“=”或“<”),且c3=1.2mol•L-1.
(4)实验4和实验1仅起始温度不同.比较实验4和实验1,可推测该反应的正反应是吸热反应(填“吸热”或“放热”),理由是实验4到达平衡时间较短,实验4温度较高,平衡时实验4反应物A的浓度小,平衡正向移动.
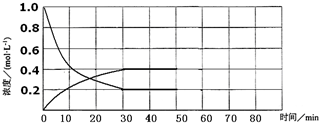
(5)实验4中,假定在50min将容器的容积缩小为原来的一半,请在如图中用曲线表示体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、D).
时间 实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | T | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1中,在10~20min时间内,以A的速率表示的平均反应速率为0.02mol/(L•min).
(2)实验2中,A的初始浓度c2=1mol•L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是使用催化剂.
(3)测得实验2和实验3各组分百分含量相等.设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3>v1(填“>”“=”或“<”),且c3=1.2mol•L-1.
(4)实验4和实验1仅起始温度不同.比较实验4和实验1,可推测该反应的正反应是吸热反应(填“吸热”或“放热”),理由是实验4到达平衡时间较短,实验4温度较高,平衡时实验4反应物A的浓度小,平衡正向移动.
(5)实验4中,假定在50min将容器的容积缩小为原来的一半,请在如图中用曲线表示体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、D).

10.目前“低碳经济”正成为科学家研究的主要课题.请回答下列问题:
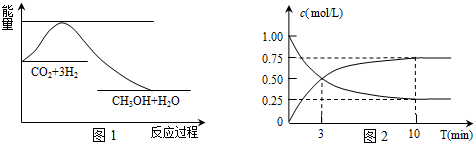
Ⅰ.(1)甲烷自热重整是一种先进的制氢方法,其反应方程式为:CH4(g)+H2O(g)?CO(g)+3H2(g)
阅读下图,计算该反应的反应热△H=+161.1kJ/mol.

(2)以CH4、O2为原料,100mL0.15mol/LNaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
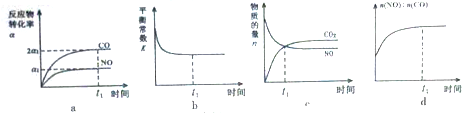
Ⅱ.一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是AD(选填字母).
Ⅲ.相同温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.相关数据如下:
请回答:
(1)n=19.6kJ.
(2)若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol•L-1•s-1.
Ⅰ.(1)甲烷自热重整是一种先进的制氢方法,其反应方程式为:CH4(g)+H2O(g)?CO(g)+3H2(g)
阅读下图,计算该反应的反应热△H=+161.1kJ/mol.

(2)以CH4、O2为原料,100mL0.15mol/LNaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
Ⅱ.一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是AD(选填字母).

Ⅲ.相同温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.相关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 平衡时c(CH3OH) | C1 | C2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
(1)n=19.6kJ.
(2)若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol•L-1•s-1.
5.300℃时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:
回答下列问题:
(1)反应0~2min Z的平均速率v(Z)=0.004 mol/(L•min)
(2)能判断该反应已经达到平衡状态的是D
A.生成X的速率是生成Z的速率的2倍 B.容器内压强保持不变
C.容器内气体的密度保持不变 D.容器内各气体的浓度保持不变
(3)要提高上述反应的转化率,可采取的措施是降低温度(任写一种).
(4)温度为300℃时,该反应的化学平衡常数K=1.44
(5)若起始时向该容器中充入X、Y、Z各0.20mol,则反应将向正(填“正”或“逆”)反应方向进行,达平衡时Z的体积分数与上述平衡相比不变(填“增大”、“减小”或“不变”)
0 172324 172332 172338 172342 172348 172350 172354 172360 172362 172368 172374 172378 172380 172384 172390 172392 172398 172402 172404 172408 172410 172414 172416 172418 172419 172420 172422 172423 172424 172426 172428 172432 172434 172438 172440 172444 172450 172452 172458 172462 172464 172468 172474 172480 172482 172488 172492 172494 172500 172504 172510 172518 203614
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
(1)反应0~2min Z的平均速率v(Z)=0.004 mol/(L•min)
(2)能判断该反应已经达到平衡状态的是D
A.生成X的速率是生成Z的速率的2倍 B.容器内压强保持不变
C.容器内气体的密度保持不变 D.容器内各气体的浓度保持不变
(3)要提高上述反应的转化率,可采取的措施是降低温度(任写一种).
(4)温度为300℃时,该反应的化学平衡常数K=1.44
(5)若起始时向该容器中充入X、Y、Z各0.20mol,则反应将向正(填“正”或“逆”)反应方向进行,达平衡时Z的体积分数与上述平衡相比不变(填“增大”、“减小”或“不变”)
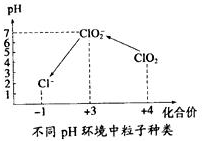 二氧化氯(C1O2)气体是一种常用高效的自来水消毒剂.
二氧化氯(C1O2)气体是一种常用高效的自来水消毒剂. 一定条件下,将1mol N2和1.0mol H2充入容积为10L的恒容密闭容器中合成NH3、N2、H2的物质的量随时间的变化曲线如图所示.
一定条件下,将1mol N2和1.0mol H2充入容积为10L的恒容密闭容器中合成NH3、N2、H2的物质的量随时间的变化曲线如图所示.