题目内容
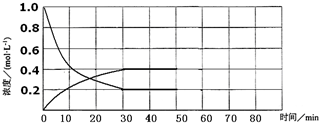
11.某化学反应2A(g)?B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况如下表:时间 实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | T | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1中,在10~20min时间内,以A的速率表示的平均反应速率为0.02mol/(L•min).
(2)实验2中,A的初始浓度c2=1mol•L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是使用催化剂.
(3)测得实验2和实验3各组分百分含量相等.设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3>v1(填“>”“=”或“<”),且c3=1.2mol•L-1.
(4)实验4和实验1仅起始温度不同.比较实验4和实验1,可推测该反应的正反应是吸热反应(填“吸热”或“放热”),理由是实验4到达平衡时间较短,实验4温度较高,平衡时实验4反应物A的浓度小,平衡正向移动.
(5)实验4中,假定在50min将容器的容积缩小为原来的一半,请在如图中用曲线表示体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、D).
分析 (1)根据v=$\frac{△c}{△t}$计算10~20min时间内A表示的平均反应速率;
(2)温度相同,达平衡后A的物质的量浓度相同,且B、D起始浓度为0,所以两组实验中A的起始浓度相同为1.0mol•L-1 ;
温度相同,达平衡后A的物质的量浓度相同,但达平衡时实验2的时间较短,所以只能是加入催化剂;
(3)实验1、3比较,温度相同,10min-20min时,实验3的浓度减少量都大于实验1的,所以实验3的反应速率大于实验1;
实验1、3 温度相同,平衡常数相同,计算实验1中平衡时各组分浓度,根据K=$\frac{c(B)×c(D)}{{c}^{2}(A)}$计算平衡常数,用c3表示出平衡时各组分浓度,再利用平衡常数列方程计算;
(4)实验4到达平衡时间较短,实验4温度较高,平衡时实验4反应物A的浓度小,平衡正向移动;
(5)实验4中,假定在50min将容器的容积缩小为原来的一半,瞬间各组分的浓度浓度增大一倍,即A的浓度变为0.4mol/L,B、D的浓度均为0.8mol/L,由于反应前后气体的物质的量不变,平衡不移动.
解答 解:(1)实验①前10min内A的平均反应速率为v=$\frac{1mol/L-0.8mol/L}{10min}$=0.02mol/(L•min),
故答案为:0.02mol/(L•min);
(2)实验1、2,温度相同,达平衡后A的物质的量浓度相同,且B、D起始浓度为0,所以两组实验中A的起始浓度相同为1.0mol•L-1 ;
温度相同,达平衡后A的物质的量浓度相同,但达平衡时2组的时间较短,所以只能是使用催化剂;
故答案为:1.0mol/L;使用催化剂;
(3)实验1、3比较,温度相同,10min-20min时,实验3的浓度减少量都大于实验1的,所以实验3的反应速率大于实验1的,即v3>v1;
实验1在40min时反应达到平衡,
2A(g)?B(g)+D(g)
起始(mol•L-1):1.0 0 0
反应(mol•L-1):0.50 0.25 0.25
平衡(mol•L-1):0.50 0.25 0.25
该温度下平衡常数K=$\frac{0.25×0.25}{0.{5}^{2}}$=0.25,
实验3的温度与实验1的温度相同,温度不变,平衡常数相同,
2A(g)?B(g)+D(g)
起始(mol•L-1):C3 0 0
反应(mol•L-1):0.6 0.30 0.30
平衡(mol•L-1):c3-0.60 0.30 0.30
该温度下平衡常数K=$\frac{0.3×0.3}{({c}_{3}-0.6)^{2}}$=0.25,解得:c3=1.2,
故答案为:>;1.2;
(4)实验4到达平衡时间较短,实验4温度较高,平衡时实验4反应物A的浓度小,平衡正向移动,所以正反应是吸热反应;
故答案为:吸;实验4到达平衡时间较短,实验4温度较高,平衡时实验4反应物A的浓度小,平衡正向移动;
(5)实验4中,假定在50min将容器的容积缩小为原来的一半,瞬间各组分的浓度浓度增大一倍,即A的浓度变为0.4mol/L,B、D的浓度均为0.8mol/L,由于反应前后气体的物质的量不变,平衡不移动,图象各物质的浓度随时间变化的趋势为 ,
,
故答案为: .
.
点评 本题考查化学平衡的计算与影响因素、反应速率计算、平衡常数应用等,侧重考查学生对数据的分析处理能力、知识迁移运用能力,题目难度中等.

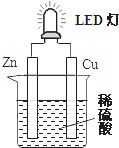
| A. | 铜片表面有气泡生成,且铜片为正极,为电子流入的一极 | |
| B. | 如果将硫酸换成苹果汁,导线中不会有电子流动 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将锌片换成铁片,电路中的电流方向由铜片经导线流向铁片,铁片发生氧化反应 |
| A. | c(A-)+c(HA)=0.02 mol•L-1 | B. | 该溶液的pH<7 | ||
| C. | HA的酸性很弱,A-水解程度较大 | D. | n(A-)+n(OH-)-n(H+)=0.01 mo1 |
| A. | 1.0 L 1.0 mo1•L-1的NaAlO2 水溶液中含有的氧原子数为2 NA | |
| B. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2 NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol 氧气转移的电子数为0.2 NA | |
| D. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5 NA |
| A. | 金属的活泼顺序为:a>c>b>d | |
| B. | 在①的溶液中,SO42-向b极移动 | |
| C. | 在③的装置中,一段时间后b电极质量将会减轻 | |
| D. | 二次电池放电时的反应和充电时的反应是可逆反应 |
 ;检验元素X、Y、Z以质量比为1:7:12形成的化合物中所含阳离子的离子反应方程式是:
;检验元素X、Y、Z以质量比为1:7:12形成的化合物中所含阳离子的离子反应方程式是: