题目内容
7.在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用.请回答下列问题: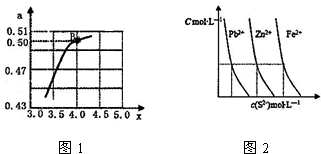
Ⅰ:工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(l).
(1)已知该反应的平衡常数K195℃<K165℃,则该反应的△H<0(填“>”“=”或“<”).
(2)一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x,图1是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大的原因是增大氨气浓度,平衡正向移动,CO2转化率增大;B点处,NH3的体积分数为85.7%(保留小数点后一位).
(3)取一定量的NH3和CO2放在一个密闭真空容器中,在一定温度下反应达平衡,若在恒温、恒容下充入气体He,CO(NH2)2的质量不变(填“增加”、“减小”或“不变”).
Ⅱ:(1)某温度下,纯水中c(H+)=2.0×10-7mol/L,该温度下,0.9mol/L NaOH溶液与0.1mol/L HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=13.
(2)向100mL 0.10mol/L CH3COOH的溶液中加入0.010mol CH3COONa固体,溶液pH增大.已知该混合溶液中c(Na+)<c(CH3COO-),则c(CH3COOH)<c(CH3COO-)(填“>”、“<”或“=”)
Ⅲ:(1)图2为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.如果向三种沉淀中加盐酸,最先溶解的是FeS(填化学式).
(2)向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀最终会转化为PbS(填化学式)沉淀.
分析 I.(1)平衡常数K195℃<K165℃,说明升高温度平衡逆向移动;
(2)增大氨气浓度,平衡正向移动,CO2转化率增大;
B点处x=4,原料气中的NH3和CO2的物质的量之比为4,假设氨气为4mol,二氧化碳为1mol,二氧化碳转化率为0.50,则反应的二氧化碳为0.50mol,根据方程式计算平衡时混合气体总物质的量,进而计算氨气体积分数;
(3)达到平衡时,在恒温、恒容下充入气体He,由于各组分的浓度没有变化,则化学平衡不会移动;
Ⅱ.(1)纯水电离生成的c(H+)=c(OH-),Kw=c(H+)×c(OH-)=4×10-14,0.9mol/L NaOH溶液与0.1mol/L HCl溶液等体积混合,溶液呈碱性,计算混合后溶液中c(OH-),利用水的离子积计算c(H+),再根据pH=-lgc(H+)计算;
(2)混合溶液中c (Na+)<c (CH3COO-),则醋酸根离子的水解程度小于醋酸的电离程度;
Ⅲ.(1)根据图2可知,PbS(s)、ZnS(s)、FeS(s)的溶度积大小关系为:Ksp(CuS)<Ksp(ZnS)<Ksp(FeS),如果向三种沉淀中加盐酸,最先溶解的是溶解度最大;
(2)由于Ksp(PbS)<Ksp(ZnS)<Ksp(FeS),ZnS沉淀会转化为更难溶的PbS.
解答 解:Ⅰ.(1)平衡常数K195℃<K165℃,说明升高温度平衡逆向移动,正反应为放热反应,△H<0,
故答案为:<;
(2)增大氨气浓度,平衡正向移动,CO2转化率增大;
B点处x=4,原料气中的NH3和CO2的物质的量之比为4,假设氨气为4mol,二氧化碳为1mol,二氧化碳转化率为0.50,则反应的二氧化碳为0.50mol,由方程式2NH3 (g)+CO2 (g)?CO(NH2)2 (l)+H2O (l),气体减少的物质的量为消耗的氨气、二氧化碳之和,故平衡时混合气体总物质的量为4mol+1mol-0.5mol-0.5mol×2=3.5mol,氨气为4mol-0.5mol×2=3mol,故氨气体积分数为$\frac{3mol}{3.5mol}$×100%=85.7%,
故答案为:增大氨气浓度,平衡正向移动,CO2转化率增大;85.7;
(3)达到平衡时,在恒温恒容条件下充入稀有气体,由于各组分的浓度没有变化,则化学平衡不会移动,CO(NH2)2(l)的质量不变,
故答案为:不变;
Ⅱ(1)纯水电离生成的c(H+)=c(OH-),Kw=c(H+)×c(OH-)=4×10-14,0.9mol/L NaOH溶液与0.1mol/L HCl溶液等体积混合,溶液呈碱性,混合后溶液中c(OH-)=$\frac{0.9V-0.1V}{2V}$mol/L=0.4mol/L,该稳定性c(H+)=$\frac{4×1{0}^{-14}}{0.4}$mol/L=10-13mol•L-1,所以pH=13,
故答案为:13;
(2)混合溶液中c (Na+)<c (CH3COO-),则醋酸根离子的水解程度小于醋酸的电离程度,所以c(CH3COOH)<c (CH3COO-),
故答案为:<;
Ⅲ.(1)根据图2可知,PbS(s)、ZnS(s)、FeS(s)的溶度积大小关系为:Ksp(CuS)<Ksp(ZnS)<Ksp(FeS),则溶解度PbS<ZnS<FeS,如果向三种沉淀中加盐酸,最先溶解的是溶解度最大的FeS,
故答案为:FeS;
(2)向新生成的ZnS浊液中滴入足量含相同浓度的Cu2+、Fe2+的溶液,由于Ksp(PbS)<Ksp(ZnS)<Ksp(FeS),溶解度PbS<ZnS<FeS,则振荡后,ZnS沉淀会转化为更难溶的PbS,
故答案为:PbS.
点评 本题考查化学平衡计算与影响因素、溶液pH的计算、难溶物溶解平衡及沉淀转化等知识,较好考查学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.

①单质;②混合物;③化合物;④纯净物;⑤氧化物.
| A. | ①②③ | B. | ③④⑤ | C. | ①③⑤ | D. | ②③④⑤ |
| A. | 25% | B. | 50% | C. | 75% | D. | 无法计算 |
| A. | 将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色 | |
| B. | 向盛有20g蔗糖的烧杯中加入几滴水,搅拌均匀:再加入少许浓硫酸,迅速搅拌,探究浓硫酸的吸水性 | |
| C. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| D. | 将表面有铜绿[Cu2(OH)2C03]的铜器放入盐酸中浸泡,除去铜绿 |
| A. | NO2体积不变 | B. | 剩余三分之一体积一氧化氮气体 | ||
| C. | 溶液充满集气瓶 | D. | 二氧化氮和一氧化氮 |
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量大于生成物总能量 | |
| B. | 若一定条件下,A═B△H<0,说明A物质比B物质稳定 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+ (aq)+OH- (aq)═H2O(l)△H=-57.3 kJ•mol-1,含1 mol NaOH的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 |
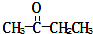 )、丙酸(CH3CH2COOH)和丁二酸(HOOCCH2CH2COOH),试推测此烃的构造式.
)、丙酸(CH3CH2COOH)和丁二酸(HOOCCH2CH2COOH),试推测此烃的构造式.