题目内容
5.300℃时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
(1)反应0~2min Z的平均速率v(Z)=0.004 mol/(L•min)
(2)能判断该反应已经达到平衡状态的是D
A.生成X的速率是生成Z的速率的2倍 B.容器内压强保持不变
C.容器内气体的密度保持不变 D.容器内各气体的浓度保持不变
(3)要提高上述反应的转化率,可采取的措施是降低温度(任写一种).
(4)温度为300℃时,该反应的化学平衡常数K=1.44
(5)若起始时向该容器中充入X、Y、Z各0.20mol,则反应将向正(填“正”或“逆”)反应方向进行,达平衡时Z的体积分数与上述平衡相比不变(填“增大”、“减小”或“不变”)
分析 (1)2min内Y物质的量变化为0.16mol-0.12mol=0.04mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(Y),再利用速率之比等于化学计量数之比计算v(Z);
(2)A.生成X的速率是生成Z的速率的2倍,均为逆反应速率;
B.恒温恒容下,反应前后气体物质的量不变,容器内压强始终保持不变;
C.容器内气体的密度始终保持不变;
D.可逆反应得到平衡时各组分的浓度保持不变;
(3)正反应为放热反应,降低温度平衡正向移动,可以移走Z使平衡正向移动;
(4)由表中数据可知7min时,反应到达平衡,根据平衡时Y的物质的量,计算平衡时其它组分的物质的量,由于反应气体氢气的化学计量数相等,用物质的量代替浓度代入平衡常数表达式K=$\frac{{c}^{2}(Z)}{c(X)×c(Y)}$计算;
(5)计算浓度商Qc,与平衡常数比较判断反应进行方向;等效为开始通入0.3molX、0.3molY,与原平衡中X、Y的物质的量之比均为1:1,该反应气体气体体积不变,恒温恒容下与原平衡为等效平衡,平衡时相同物质的体积分数相同.
解答 解:(1)2min内Y物质的量变化为0.16mol-0.12mol=0.04mol,则v(Y)=$\frac{\frac{0.04mol}{10L}}{2min}$=0.002 mol/(L•min),速率之比等于化学计量数之比,v(Z)=2v(Y)=0.004 mol/(L•min),
故答案为:0.004 mol/(L•min);
(2)A.生成X的速率是生成Z的速率的2倍,均为逆反应速率,自反应开始始终满足该关系,故A错误;
B.恒温恒容下,反应前后气体物质的量不变,容器内压强始终保持不变,故B错误;
C.混合气体总质量不变,容器容积不变,容器内气体的密度始终保持不变,故C正确;
D.容器内各气体的浓度保持不变,说明反应到达平衡,故D正确,
故选:D;
(3)正反应为放热反应,降低温度平衡正向移动,可以移走Z使平衡正向移动,提供反应的转化率,
故答案为:降低温度;
(4)由表中数据可知7min时,反应到达平衡,平衡时Y的物质的量为0.1mol,则:
X(g)+Y(g)?2Z(g)
起始量(mol):0.16 0.16 0
变化量(mol):0.06 0.06 0.12
平衡量(mol):0.1 0.1 0.12
由于反应气体氢气的化学计量数相等,用物质的量代替浓度计算,平衡常数K=$\frac{{c}^{2}(Z)}{c(X)×c(Y)}$=$\frac{0.1{2}^{2}}{0.1×0.1}$=1.44,
故答案为:1.44;
(5)此时浓度商Qc=$\frac{0.{2}^{2}}{0.2×0.2}$=1<K=1.44,平衡向正反应进行;
等效为开始通入0.3molX、0.3molY,与原平衡中X、Y的物质的量之比均为1:1,该反应气体气体体积不变,恒温恒容下与原平衡为等效平衡,即达平衡时Z的体积分数与上述平衡相比保持不变,
故答案为:正;不变.
点评 本题考查化学平衡计算、平衡状态判断、平衡常数等,(5)中注意平衡常数的应用、注意对等效平衡规律的理解掌握,难度中等.

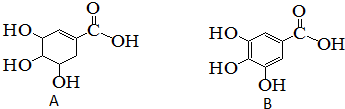
| A. | 化合物A和B遇三氯化铁溶液都显紫色 | |
| B. | 化合物A和B中所含官能团相同 | |
| C. | 等物质的量的A和B分别与足量的NaOH溶液反应,消耗NaOH的量相同 | |
| D. | 化合物A和B都能与溴水反应 |
(1)甲烷是一种重要的清洁燃料
①甲烷燃烧放出大量的热,可直接作为能源用于人类的生产和生活.
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
则表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890KJ.mol-1;请从化学反应的本质解释甲烷燃烧放出热量的原因:化学反应过程中,反应物化学键的破坏需要吸收能量,而生产物化学键的形成要放出能量,当化学键的破坏需要吸收能量小于化学键的形成要放出能量.
②在甲烷燃料电池中,甲烷的化学能利用率大大提高.将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,其负极电极反应式是:CH4-8e-+10 OH-=CO32-+7H2O.
(2)二甲醚也是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.
①利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ/mol
该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是bd (填字母代号).
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
②二甲醚也可以通过CH3OH分子间脱水制得
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
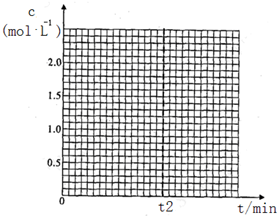
已知在280℃,体积不变的密闭容器中进行上述反应,t2时达到平衡,各组分起始和平衡浓度见下表.
| CH3OH(g) | CH3OCH3(g) | H2O(g) | |
| 起始浓度 mol/L | 2.00 | 0.50 | 0 |
| 平衡浓度 mol/L | c1 | 1.00 | c2 |
在t2min内平均反应速率v(H2O)=$\frac{1}{2{t}_{2}}$mol/(L.min).
②若在400℃,相同的密闭容器中进行上述反应,请在下图中画出CH3OCH3浓度随时间变化的关系图(要求同时画出280℃的,并做好标注).
Ⅰ.(1)甲烷自热重整是一种先进的制氢方法,其反应方程式为:CH4(g)+H2O(g)?CO(g)+3H2(g)
阅读下图,计算该反应的反应热△H=+161.1kJ/mol.

(2)以CH4、O2为原料,100mL0.15mol/LNaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
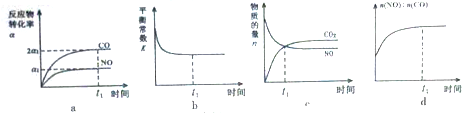
Ⅱ.一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n(NO):n(CO)=2:1的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是AD(选填字母).
Ⅲ.相同温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.相关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 平衡时c(CH3OH) | C1 | C2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
(1)n=19.6kJ.
(2)若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol•L-1•s-1.
| A. | Na3N与水的反应是氧化还原反应 | |
| B. | Na3N 是共价化合物 | |
| C. | Na3N中4个离子均满足最外层8电子稳定结构 | |
| D. | Na3N中钠离子半径大于氮离子半径 |
| A. | 稀醋酸中加入少量醋酸钠固体能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液呈中性 | |
| C. | 25℃时,0.1mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| D. | FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 |
| A. | 18y/x | B. | 9y/x | C. | 18y/x mol-1 | D. | 9y/x mol-1 |