题目内容
4.实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ•mol-1)的变化.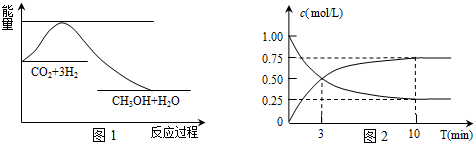
(1)关于该反应的下列说法中,正确的是A(填字母).
A.△H<0,△S<0 B.△H>0,△S<0
C.△H>0,△S>0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示.
①从反应开始到平衡,H2的平均反应速率v(H2)=0.225mol/(L•min);CO2的转化率a(CO2)=75%.
②该反应的平衡常数K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.75mol/L×0.75mol/L}{0.25mol/L×(1.75mol/L)^{3}}$.(只列表达式和计算式,不必计算出结果)
③下列措施中能使化学平衡向正反应方向移动的是AD (填字母).
A.将CH3OH(g)及时液化抽出B.升高温度
C.选择高效催化剂D.再充入l molCO2和4molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出350.8kJ的热量,写出该反应的热化学方程式:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-701.6 kJ•mol-1.
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,其负极的电极反应式是:CH3OH+8OH?-6e-=CO32-+6H2O.
分析 (1)正反应气体的物质的量减少,混乱度减小;由于反应物能量高于生成物的能量,反应是放热反应;
(2)二氧化碳是反应物,随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大,10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L,则:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
起始量(mol/L):1 4 0 0
变化量(mol/L):0.75 2.25 0.75 0.75
平衡量(mol/L):0.25 1.75 0.75 0.75
①根据c=$\frac{△c}{△t}$计算v(H2),二氧化碳转化率=$\frac{C{O}_{2}浓度变化量}{C{O}_{2}起始浓度}$×100%;
②平衡常数K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$;
③A.将CH3OH(g)及时液化抽出,减小生成物的量平衡正向进行;
B.反应是放热反应,升温平衡逆向进行;
C.选择高效催化剂只能改变速率,不改变化学平衡;
D.再充入l molCO2和3molH2,增大压强平衡正向进行;
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出350.8kJ的热量,则1mol甲醇完全燃烧恢复到原状态时,放出热量=350.8kJ×$\frac{1mol×32g/mol}{16g}$=701.6kJ,注明物质的聚集状态与反应热书写热化学方程式;
(4)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水.
解答 解:(1)正反应气体的物质的量减少,混乱度减小,故△S<0;由于反应物能量高于生成物的能量,反应是放热反应,则△H<0,
故选:A;
(2)二氧化碳是反应物,随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大,10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L,则:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
起始量(mol/L):1 4 0 0
变化量(mol/L):0.75 2.25 0.75 0.75
平衡量(mol/L):0.25 1.75 0.75 0.75
①则v(H2)=$\frac{2.25mol/L}{10min}$=0.225mol/(L•min),二氧化碳转化率=$\frac{0.75mol/L}{1mol/L}$×100%=75%,
故答案为:0.225mol/(L•min);75%;
②平衡常数K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.75mol/L×0.75mol/L}{0.25mol/L×(1.75mol/L)^{3}}$,
故答案为:$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.75mol/L×0.75mol/L}{0.25mol/L×(1.75mol/L)^{3}}$;
③A.将CH3OH(g)及时液化抽出,减小生成物的量平衡正向进行,故A正确;
B.反应是放热反应,升温平衡逆向进行,故B错误;
C.选择高效催化剂只能改变速率,不改变化学平衡,故C错误;
D.再充入l molCO2和3molH2,增大压强平衡正向进行,故D正确,
故选:AD;
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出350.8kJ的热量,则1mol甲醇完全燃烧恢复到原状态时,放出热量=350.8kJ×$\frac{1mol×32g/mol}{16g}$=701.6kJ,故甲醇燃烧的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-701.6 kJ•mol-1;
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-701.6 kJ•mol-1;
(4)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH3OH+8OH?-6e-=CO32-+6H2O,
故答案为:CH3OH+8OH?-6e-=CO32-+6H2O.
点评 本题考查化学平衡计算与影响因素、热化学方程式书写、原电池等,注意对你基础知识的理解掌握,难度中等.

| A. | 1 mo1 N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数2NA | |
| B. | 1 mol•L-1 FeCl3溶液中所含Cl-的数目为3NA | |
| C. | 标准状况下,22.4L14CO2与44g14CO2所含分子数均为NA | |
| D. | 标准状况下,16 g O3和O2混合气体中含有的氧原子数为NA |
| A. | c(A-)+c(HA)=0.02 mol•L-1 | B. | 该溶液的pH<7 | ||
| C. | HA的酸性很弱,A-水解程度较大 | D. | n(A-)+n(OH-)-n(H+)=0.01 mo1 |

 一定条件下,将1mol N2和1.0mol H2充入容积为10L的恒容密闭容器中合成NH3、N2、H2的物质的量随时间的变化曲线如图所示.
一定条件下,将1mol N2和1.0mol H2充入容积为10L的恒容密闭容器中合成NH3、N2、H2的物质的量随时间的变化曲线如图所示.



